
【题目】对于SO2和CO2的说法中正确的是( )
A. 都是直线形结构
B. 中心原子都采用SP杂化轨道
C. SO2为V形结构,CO2为直线形结构
D. S原子和C原子上都没有孤对电子
【答案】C
【解析】试题分析:A.SO2的价层电子对个数=2+![]() (6-2×2)=3,含有1个孤电子对,该分子为V形结构,CO2的价层电子对个数=2+
(6-2×2)=3,含有1个孤电子对,该分子为V形结构,CO2的价层电子对个数=2+![]() (4-2×2)=2,该分子是直线形结构,故A错误;B.SO2的价层电子对个数是3,所以硫原子采取sP2杂化,CO2的价层电子对个数是2,所以碳原子采取sP杂化,故B错误;C.SO2的价层电子对个数=2+
(4-2×2)=2,该分子是直线形结构,故A错误;B.SO2的价层电子对个数是3,所以硫原子采取sP2杂化,CO2的价层电子对个数是2,所以碳原子采取sP杂化,故B错误;C.SO2的价层电子对个数=2+![]() (6-2×2)=3,该分子为V形结构,CO2的价层电子对个数=2+
(6-2×2)=3,该分子为V形结构,CO2的价层电子对个数=2+![]() (4-2×2)=2,该分子是直线形结构,故C正确;D.SO2的孤电子对个数=
(4-2×2)=2,该分子是直线形结构,故C正确;D.SO2的孤电子对个数=![]() (6-2×2)=1,CO2的孤电子对个数=
(6-2×2)=1,CO2的孤电子对个数=![]() (4-2×2)=0,所以二氧化硫有1对孤对电子,二氧化碳没有孤对电子,故D错误。
(4-2×2)=0,所以二氧化硫有1对孤对电子,二氧化碳没有孤对电子,故D错误。


科目:高中化学 来源: 题型:
【题目】符合右图的反应是
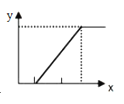
x轴 | y轴 | ||
A | 向氯化铝溶液中加入氢氧化钠溶液 | 氢氧化钠的物质的量 | 生成沉淀的质量 |
B | 向碳酸钠溶液中加入稀盐酸 | 盐酸的体积 | 产生气体的体积 |
C | 向溴化亚铁溶液中通入氯气 | 氯气的体积 | 生成Br2的物质的量 |
D | 向氢氧化钙溶液中通入二氧化碳 | 二氧化碳的体积 | 生成碳酸氢钙的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确是
A. 符合分子通式CnH2n+2的烃一定都是烷烃,分子中均只含单键
B. 通过石油裂化可以得到多种气态短链烃,其中包括重要化工原料
C. 苯能使溴水褪色,说明苯环结构中含有碳碳双键
D. 乙醇可以被氧气氧化成乙酸,但乙酸无法再被氧气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4].CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式).
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列 .
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的.镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 .
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 .
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素的原子序数依次增大.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.试回答:
(1)写出下列元素的符号A ,D ,E ;
(2)用电子式表示B、F形成的化合物 ;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式 ;
(4)D的固态氧化物是 晶体.含n mol D的氧化物的晶体中含D﹣0共价键为 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语回答下列问题:
(1)画出S2﹣的结构示意图: .
(2)写出氨气分子的电子式: .
(3)写出氮气分子的结构式 .
(4)苯酚钠溶液与过量CO2反应的化学方程式 .
(5)CH3CHO与银氨溶液反应的化学方程式: .
(6)CH2=CH﹣COOCH3在一定条件下发生加聚反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器:①试管 ②坩埚 ③量筒 ④蒸发皿 ⑤烧瓶 ⑥集气瓶 ⑦烧杯 ⑧漏斗,可以用酒精灯直接加热的是( )
A. ①②③④⑤⑧ B. ①②④
C. ①③⑥⑦⑧ D. 都能直接加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com