
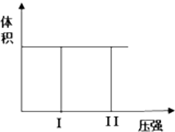
 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
| 1 |
| 2.5 |


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
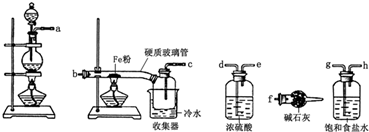
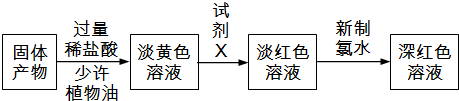
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑ |
| B、Na2S+2CH3COOH(少量)=2CH3COONa+H2S↑ |
| C、Na2S(少量)+CH3COOH=CH3COONa+NaHS |
| D、CH3COOH+NaHS=CH3COONa+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A |
| B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeO |
| B、Fe3O4 |
| C、Fe2O3 |
| D、FeO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素位于第5周期,ⅢB族 |
| B、该元素原子核外有5个电子层 |
| C、该元素原子最外层共有3个电子 |
| D、该元素原子M能层共有18个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaOH溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| B、用丁达尔效应鉴别碳酸溶液和硅酸溶胶 |
| C、用焰色反应鉴别KCl和KNO3 |
| D、用澄清石灰水鉴别SO2和CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com