
����Ŀ�������Ȼ�ѧ����ʽ�����ӷ���ʽ�У���ȷ���ǣ�
A������ı�ȼ����Ϊ890.3 kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H=-890.3 kJ/mol
B��CO(g)��ȼ������283.0 kJ/mol ����2CO2(g)=2CO(g)+O2(g)�ķ�Ӧ����H=+2��283.0 kJ/mol
C��NaOH��HCl��Ӧ���к��� ��H=-57.3kJ/mol����H2SO4��Ca(OH)2��Ӧ���к�����H=2��(-57.3)kJ/mol
D��500����30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g) ![]() 2NH3(g) ��H=-38.6kJ/mol
2NH3(g) ��H=-38.6kJ/mol
���𰸡�B
��������
���������A�������ȼ����Ϊ890.3kJmol-1���������ȷ��ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)�TCO2(g)+2H2O(l)��H=-890.3kJmol-1����A����B��CO(g)��ȼ������283.0 kJ/mol ����2CO(g)+O2(g)=CO2(g)��H=-2��283.0 kJ/mol����2CO2(g)=2CO(g)+O2(g)�ķ�Ӧ����H=+2��283.0 kJ/mol����B��ȷ��C���к��ȱ�ʾ����ǿ���ǿ�Ӧ����1molˮ�Ϳ������ηų����ȣ���H2SO4��Ca(OH)2��Ӧ���ɵ���CsSO4�ܣ���C����D��500����30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)�����ڸ÷�ӦΪ���淴Ӧ����0.5mol������ȫ��Ӧ���ȴ���19.3kJ��1mol������ȫ��Ӧ�ų���������38.6kJ����D����ΪB��


 ��������ѧ����ϵ�д�
��������ѧ����ϵ�д� ��Ԫ������ĩ��ϵ�д�
��Ԫ������ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����ʹ��ɫʯ����Һ�����ɫ���ǣ� ��
A.Cl2
B.NaClO
C.Na2O2
D.NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�ӦSO2+2H2S�T3S+2H2O�У����������뻹ԭ��������ʵ���֮��Ϊ�� ��
A.1��1
B.2��1
C.1��2
D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ������ ��
A����ʽ�ε�ˮ��Һһ���Լ���
B��ֻҪ��ͼ�����ʵ���Ũ�Ⱥ�����ֱ���ȣ����Ƿ�Ӧ�����Һ�ͳ�����
C����ˮ����������Ϊˮ�������ӵ����ʵ���Ũ�Ⱥ����������ӵ����ʵ���Ũ�����
D��̼����Һ�������ӵ����ʵ���Ũ����̼������ӵ����ʵ���Ũ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ͬ���ʵ���Ũ�ȵ�HC1��Һ���ֱ�ζ����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L-1�������ּ�(AOH��BOH��DOH)��Һ���ζ���������ͼ��ʾ�������ж���ȷ����
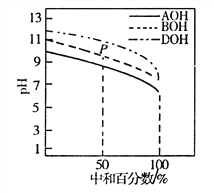
A. �ζ�ʱ������������Һ�ĵ��룬ˮ�������c(H+)ʼ������
B. �ζ���P��ʱ����Һ�У�c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7ʱ��������Һ��c(C1-)���
D. ���кͰٷ�����100��ʱ����������Һ��Ϻ�c(AOH)+c(BOH)+c(DOH)=c(H+)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ2A(g)+B(g) =C(g)+3D(g)���淴Ӧ�ڵ��������Է����У���÷�Ӧ�Ħ�H����SӦΪ( )
A. ��H��0����S��0 B. ��H��0����S��0
C. ��H��0����S��0 D. ��H��0����S��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ����������Cu��Zn��CuO��ZnO��������FeO��Fe2O3�������Ȼ�ͭ������������£�

��1����Ӧ��������Zn�۲��ܹ�����ԭ����______________________
��2����Һ���к��е���Ҫ������������___________________
��3��д����Ӧ��Ļ�ѧ����ʽ____________________________________________________
��4����ϵ�в�������������Ũ������ȴ�ᾧ�����ˡ�__________��___________��
��5���ڿ�����ֱ�Ӽ���CuCl2��xH2O����ò���������ˮCuCl2��ԭ����___________________________________________________���û�ѧ����ʽ��ʾ��
��6��CuCl2��xH2O������xֵ�IJⶨ����ȡ3.420g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO3 4.400��10-2mol��AgNO3��Һ����Һ�г�Cl- �⣬����������Ag+��Ӧ�����ӣ�����Cl- ��ȫ�������ú�Fe3+����Һ��ָʾ������0.2000 mol��L-1��KSCN����Һ�ζ�ʣ���AgNO3��ʹʣ���Ag+��AgSCN��ɫ��������ʽ������
�ٵζ��յ��������_______________________________________��
�����ζ�������ȥ����Ũ�ȵ�KSCN����Һ20.00mL����CuCl2��xH2O��xֵΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ������ﴦ����KCN�ķ�ˮ����һ������������������������£���KCNת����KHCO3��NH3�����pH : 6.7��7.2)���ڶ����ǰѰ�ת��Ϊ���NH3+202![]() HNO3+H2O
HNO3+H2O
�����������գ�
��1��д����һ����Ӧ�Ļ�ѧ��Ӧ����ʽ_____________���ڶ�����Ӧ�Ļ�ԭ������_____________ ����д��ѧʽ����
��2����KCN�У����ڶ�������ԭ�Ӱ뾶����Ԫ����_____����ԭ���������ӵ��˶�״̬��_______�֡�ˮ�ĵ���ʽ��________��
��3���Ƚ�̼�͵�Ԫ�طǽ�����ǿ������ѧ��Ӧ����ʽΪ_____________��
��4�������£�0.lmol/LK2CO3��KCN��KHCO3��Һ���ʼ�����pH���μ�С���ں������ʵ�����KCN��KHCO3�����Һ�У������ӣ���OH-��Ũ���ɴ�С��˳����_____________��
��5����ҵ�ϻ�������������������KCN�ķ�ˮ��KCN+2KOH+Cl2=KOCN+2KCl+H2O��2KOCN+4KOH+3Cl2��N2+6KCl+2CO2+2H2O��������ȣ����ﴦ�������ŵ���ȱ���ǣ���дһ������
�ŵ㣺________��ȱ�㣺__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������仯����
A. ʯ�͵ķ��� B. ú��Һ�� C. ú�ĸ��� D. ���͵��ѻ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com