
����Ŀ����ҵ�Ͽ������ﴦ����KCN�ķ�ˮ����һ������������������������£���KCNת����KHCO3��NH3�����pH : 6.7��7.2)���ڶ����ǰѰ�ת��Ϊ���NH3+202![]() HNO3+H2O
HNO3+H2O
�����������գ�
��1��д����һ����Ӧ�Ļ�ѧ��Ӧ����ʽ_____________���ڶ�����Ӧ�Ļ�ԭ������_____________ ����д��ѧʽ����
��2����KCN�У����ڶ�������ԭ�Ӱ뾶����Ԫ����_____����ԭ���������ӵ��˶�״̬��_______�֡�ˮ�ĵ���ʽ��________��
��3���Ƚ�̼�͵�Ԫ�طǽ�����ǿ������ѧ��Ӧ����ʽΪ_____________��
��4�������£�0.lmol/LK2CO3��KCN��KHCO3��Һ���ʼ�����pH���μ�С���ں������ʵ�����KCN��KHCO3�����Һ�У������ӣ���OH-��Ũ���ɴ�С��˳����_____________��
��5����ҵ�ϻ�������������������KCN�ķ�ˮ��KCN+2KOH+Cl2=KOCN+2KCl+H2O��2KOCN+4KOH+3Cl2��N2+6KCl+2CO2+2H2O��������ȣ����ﴦ�������ŵ���ȱ���ǣ���дһ������
�ŵ㣺________��ȱ�㣺__________________��
���𰸡� 2KCN+O2+4H2O![]() 2KHCO3+2NH3 (2�֣�HNO3 H2O ̼(C) 5
2KHCO3+2NH3 (2�֣�HNO3 H2O ̼(C) 5 ![]() NaHCO3+HNO3=NaNO3+CO2��+H2O c(HCO3-)>c(CN-)>c(CO32-) ������Һ��й©�� ������Ӧ�Բ�ȡ�
NaHCO3+HNO3=NaNO3+CO2��+H2O c(HCO3-)>c(CN-)>c(CO32-) ������Һ��й©�� ������Ӧ�Բ�ȡ�
����������1�����ݵ��ӵ�ʧ�غ��ԭ���غ��֪��Ӧ�ﻹ��ˮ�����ε�һ����Ӧ�Ļ�ѧ��Ӧ����ʽΪ2KCN+O2+4H2O![]() 2KHCO3+2NH3���ڶ�����Ӧ������������������ԭ������HNO3��H2O����2����KCN�У����ڶ����ڵ���C��N��ͬ������������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶����Ԫ����C����ԭ���������5�����ӣ����ε��ӵ��˶�״̬��5�֡�ˮ�ǹ��ۻ��������ʽ��
2KHCO3+2NH3���ڶ�����Ӧ������������������ԭ������HNO3��H2O����2����KCN�У����ڶ����ڵ���C��N��ͬ������������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶����Ԫ����C����ԭ���������5�����ӣ����ε��ӵ��˶�״̬��5�֡�ˮ�ǹ��ۻ��������ʽ��![]() ����3����������̼�����Ʒ�Ӧ����̼�ᣬ˵����Ԫ�صķǽ�����ǿ��̼Ԫ�أ���ѧ��Ӧ����ʽΪNaHCO3+HNO3=NaNO3+CO2��+H2O����4��������0.lmol/LK2CO3��KCN��KHCO3��Һ���ʼ�����pH���μ�С��˵��������ӵ�ˮ��̶����μ�С�������ں������ʵ�����KCN��KHCO3�����Һ�У������ӣ���OH-��Ũ���ɴ�С��˳����c(HCO3-)>c(CN-)>c(CO32-)����5�����ݷ�Ӧ�ķ���ʽ���ж����ﴦ�������ŵ��ǣ���ȱ����������Ӧ�Բ�ȡ�
����3����������̼�����Ʒ�Ӧ����̼�ᣬ˵����Ԫ�صķǽ�����ǿ��̼Ԫ�أ���ѧ��Ӧ����ʽΪNaHCO3+HNO3=NaNO3+CO2��+H2O����4��������0.lmol/LK2CO3��KCN��KHCO3��Һ���ʼ�����pH���μ�С��˵��������ӵ�ˮ��̶����μ�С�������ں������ʵ�����KCN��KHCO3�����Һ�У������ӣ���OH-��Ũ���ɴ�С��˳����c(HCO3-)>c(CN-)>c(CO32-)����5�����ݷ�Ӧ�ķ���ʽ���ж����ﴦ�������ŵ��ǣ���ȱ����������Ӧ�Բ�ȡ�


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������4��ҩƷ�����Ѿ����������Ʒ��
ҩƷ�� | �׳� | �ҳ� | ���� | ���� |
ҩƷ | ���ᣬ���� | �������ƣ��������� | ���ף��� | ͭ��п |
ʵ�����¹���һЩ�⣬Ӧ�ý���Щ����ڣ� ��
A.�׳�
B.�ҳ�
C.����
D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�����ӷ���ʽ�У���ȷ���ǣ�
A������ı�ȼ����Ϊ890.3 kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H=-890.3 kJ/mol
B��CO(g)��ȼ������283.0 kJ/mol ����2CO2(g)=2CO(g)+O2(g)�ķ�Ӧ����H=+2��283.0 kJ/mol
C��NaOH��HCl��Ӧ���к��� ��H=-57.3kJ/mol����H2SO4��Ca(OH)2��Ӧ���к�����H=2��(-57.3)kJ/mol
D��500����30MPa�£���0.5mol N2��1.5molH2�����ܱյ������г�ַ�Ӧ����NH3(g)������19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g) ![]() 2NH3(g) ��H=-38.6kJ/mol
2NH3(g) ��H=-38.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ȼ����־�������ҹ���ѧ��ͨ������SiO2��26Al��10Be����Ԫ�صı���ȷ���������ˡ�������о���������ֲ��������С�������귨�� �����������գ�
(l)l0Be��9Be_______��
a.��ͬһ��ԭ�� b.������ͬ��������
d.������ͬ�Ļ�ѧ���� d.��Ϊͬλ��
��д��A1��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ:___________________________��
(3)�о�����28A1����˥��Ϊ26Mg�����ԱȽ�������Ԫ�ؽ�����ǿ���ķ�����__________��
a.�Ƚ�Mg (OH) 2��A1 (OH) 3�ļ���ǿ��
b.���Ȼ������Ȼ�þ����Һ�зֱ�μӹ���������������Һ
c.����ĥ����þ������Ƭ�ֱ����ˮ���ã��������̪��Һ
d.�Ƚ�������Ԫ�صĵ��ʵ�Ӳ�Ⱥ��۵�
(4)Ŀǰ����һ�ֲ��������С���벲��귨����д����Ar��������Ų���ͬ�ij��������ӵİ뾶�ɴ�С��˳��_______(�û�ѧ���ű�ʾ)������һ���������ͬ��������Ԫ�ص��������γɵĻ������������������õ���ʽ��ʾ�����ʵ��γɹ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2015�㶫]��ѧ��������ѧ��������ѧ���������������˵����ȷ����
A��ľ����ά��������������ˮ������ɫ
B��ʳ�û����ͺͼ����嶼�ܷ���ˮ�ⷴӦ
C����װ�ò��Ͼ���ϩ�;�����ϩ��������
D��PX��Ŀ����Ҫ��Ʒ�Զ��ױ����ڱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4��һ�ֶ�Ԫ���ᣬH2C2O4��Һ�и�����Ũ��������Ũ������ռ��ֵ����ֲ�ϵ����������ijŨ�ȵ�H2C2O4��Һ�и�����ֲ�ϵ����pH�ı仯��ͼ��ʾ���ݴ˷���������˵������ȷ����
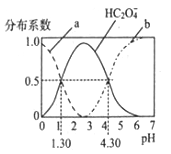
A. ����a����H2C2O4������b����C2O42-
B. ������0.1mol/L��NaHC2O4��Һ������
C. �����£�H2C2O4�ĵ���ƽ�ⳣ��Ka2=10-4..30
D. pH��1.30��4.30ʱ��  ��������С
��������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��ƻ�������������������ȡ��������Һ���䷴Ӧԭ��Ϊ�������ӷ���ʽ��ʾ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�����ܡ�����ͭ�Ƚ����γɵĺϽ����ں��ա�����������DZ����߶˿Ƽ�����
��1�����Ļ�̬ԭ�ӵļ۵��Ӳ��Ų�ʽ��__________________��
��2���Ȼ�����(CrO2Cl2)���۵�Ϊ��96.5�棬�е�Ϊ117�棬��̬�Ȼ���������_______���塣�Ʊ�CrO2Cl2�ķ�ӦΪK2Cr2O7��3CCl4=2KCl��2CrO2Cl2��3COCl2����COCl2�����ЦҼ��ͦм��ĸ�����Ϊ_____���ռ乹��Ϊ_______��CCl4������ԭ���ӻ�����Ϊ________����ȵ�����Ϊ___________��д��һ��������ʽ����
��3��ij�������ṹ����ͼ��ʾ��
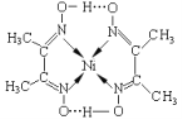
�����ں��е���������_________________(�����)���������ڵڶ�����Ԫ�صĵ�һ�������ɴ�С��˳����_____________(��Ԫ�ط���)��
A����� B�����Ӽ� C�����ۼ� D�������� E����λ��
��4����CuSO4��Һ��ͨ�백���õ�����ɫ��Һ�����ӷ���ʽΪ___________________��
��5��CoCl3��4NH3����ԭ��Co3����λ��Ϊ6����0.1 mol CoCl3��4NH3����Һ�еμ�2 mol��L��1 AgNO3��Һ����Ӧ��ȫ������50 mL��Һ����������Ļ�ѧʽΪ________________��
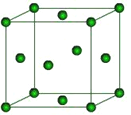
��6����ͼ��Fe�ľ���һ�ֶѻ���ʽ���������ı߳�Ϊa pm��������ܶ�Ϊ_______g��cm��3������a��NA�ı���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com