
【题目】铬同铁、钴、镍、铜等金属形成的合金,用于航空、宇航、电器、仪表及高端科技领域。
(1)铬的基态原子的价电子层排布式是__________________;
(2)氯化铬酰(CrO2Cl2)的熔点为-96.5℃,沸点为117℃,固态氯化铬酰属于_______晶体。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑,COCl2分子中σ键和π键的个数比为_____,空间构型为_______;CCl4的中心原子杂化类型为________,其等电子体为___________(写出一个离子形式);
(3)某镍配合物结构如下图所示。
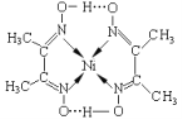
分子内含有的作用力有_________________(填序号),其中属于第二周期元素的第一电离能由大到小的顺序是_____________(填元素符号);
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为___________________;
(5)CoCl3·4NH3中心原子Co3+配位数为6,向含0.1 mol CoCl3·4NH3的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全共消耗50 mL溶液,则该配合物的化学式为________________;
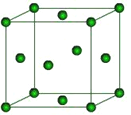
(6)下图是Fe的晶体一种堆积方式,若晶胞的边长为a pm,则晶体的密度为_______g·cm-3(用含a和NA的表达式表示)。
【答案】 3d54s1 分子 3:1 平面三角形 sp3 SO42-等 ACE N>O>C 4NH3+Cu2+=[Cu(NH3)4]2+ Co(NH3)4Cl2]Cl 224×1030/a3NA
【解析】(1)铬的核电荷数为24,其基态原子的电子排布式为[Cr]3d54s1 ,则基态原子的价电子层排布式是3d54s1 ;
(2)常温下为暗红色液体,熔沸点低,其构成微粒为分子,则固态氯化铬酰属于分子晶体。COCl2分子中含有碳氧双键,1个COCl2分子中含有2个碳氢σ键,1个碳氧σ键,共有3个σ键,π键的个数为1,COCl2分子中σ键和π键的个数比为3:1,则碳原子轨道的杂化类型为sp2杂化,分子的空间构型为平面三角;CCl4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+![]() (4-4×1)=4,且不含孤电子对,所以中心原子杂化类型为sp3 ,其等电子体为 SO42-;
(4-4×1)=4,且不含孤电子对,所以中心原子杂化类型为sp3 ,其等电子体为 SO42-;
(3)根据图可知碳碳间、碳氮间为共价键,氮镍间为配位键,氧氢间为氢键,故选ACE;
(4)向CuSO4溶液中通入氨气得到[Cu(NH3)4]2+ 的离子方程式为4NH3+Cu2+=[Cu(NH3)4]2+ ;
(5)能和硝酸银反应生成白色沉淀的是配合物中外界氯离子,n(AgNO3)=2molL-1×0.05L=0.1mol,0.1molCoCl3·4NH3和0.1mol硝酸银反应生成氯化银沉淀,所以该配合物外界氯离子个数是1,配合物CoCl3·4NH3则有2个氯原子是配位原子,该配合物的配位数是6,所以有4个氨分子是配体,则该配离子的化学式为Co(NH3)4Cl2]Cl;
(6)晶体中Fe的原子数为8×![]() +6×
+6×![]() =4,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则晶体的密度为
=4,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则晶体的密度为![]() g/cm3=224×1030/a3NAg/cm3。
g/cm3=224×1030/a3NAg/cm3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】工业上可用微生物处理含KCN的废水。第一步是微生物在氧气充足的条件下,将KCN转化成KHCO3和NH3(最佳pH : 6.7~7.2);第二步是把氨转化为硝酸:NH3+202![]() HNO3+H2O
HNO3+H2O
请完成下列填空:
(1)写出第一步反应的化学反应方程式_____________,第二步反应的还原产物是_____________ (填写化学式)。
(2)在KCN中,属于短周期且原子半径最大的元素是_____,氮原子最外层电子的运动状态有_______种。水的电子式是________。
(3)比较碳和氮元素非金属性强弱,化学反应方程式为_____________。
(4)室握下,0.lmol/LK2CO3、KCN、KHCO3溶液均呈碱性且pH依次减小,在含等物质的量的KCN、KHCO3混合溶液中,阴离子(除OH-)浓度由大到小的顺序是_____________。
(5)工业上还常用氯氧化法处凡含KCN的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2→N2+6KCl+2CO2+2H2O。两扮相比,微生物处理法的优点与缺点是(各写一条)。
优点:________;缺点:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。

(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下图是综合利用该酸洗废液的工艺流程:
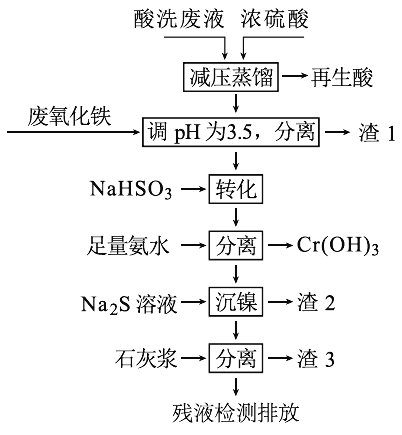
已知:
金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为____________,
(2)滤渣1的主要成份为:____________。
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:____________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和_____。
(6)经检测,最后的残液中c(Ca2+)=0.001 molL-1,则残液中F-浓度为____mgL-1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL-1]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
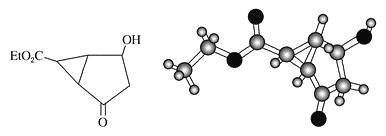
该有机分子的核磁共振氢谱图如下(单位是ppm)。
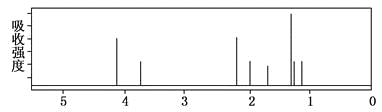
下列关于该有机物的叙述不正确的是
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物与氢氧化钠的醇溶液共热时可以发生消去反应
C. 键线式中的Et代表的基团为—CH2CH3
D. 1mol该有机物最多可以与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【全国校级联考.2017届浙江省稽阳联谊学校高三3月选考】常温下,0.2 moI·L-l的Na2CO3溶液与0.2 moI·L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是
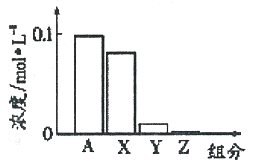
A. A代表Na+浓度
B. 该溶液中c(OH-)>c(Y)
C. 向该溶液中加水稀释,所有离子浓度均减小
D. 该混合溶液中:c(X)+c(Y)+c(Z)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在体积不变的容器中进行反应:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.7 kJmol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:( )
CH3OH(g) △H1=-90.7 kJmol-1。已知反应的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L;5 min后反应达平衡,此时CO的转化率为50%。则下列说法正确的是:( )
A.该反应属于熵增放热反应,一定能自发进行
B.5 min内H2的平均反应速率为0.1 mol/(L·min)
C.若该温度下,反应物的起始浓度c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a=5.4
D.其它条件不变的情况下,加入催化剂可提高CO的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com