
【题目】【全国校级联考.2017届浙江省稽阳联谊学校高三3月选考】常温下,0.2 moI·L-l的Na2CO3溶液与0.2 moI·L-l的盐酸等体积混合后,所得溶液中部分微粒组分与浓度的关系如图所示,X、Y、Z均表示含碳微粒,下列说法正确的是
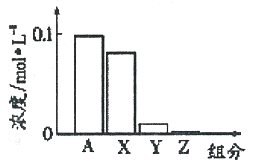
A. A代表Na+浓度
B. 该溶液中c(OH-)>c(Y)
C. 向该溶液中加水稀释,所有离子浓度均减小
D. 该混合溶液中:c(X)+c(Y)+c(Z)=2c(Na+)
【答案】B
【解析】A、发生反应是Na2CO3+HCl=NaHCO3+NaCl,根据钠元素守恒,c(Na+)=0.2×2/2mol·L-1=0.2mol·L-1,故错误;B、反应后溶质为NaHCO3和NaCl,其中NaHCO3溶液显碱性,HCO3-发生水解,HCO3-+H2O![]() H2CO3+OH-,水解程度微弱,即X为HCO3-,Y为H2CO3,Z为CO32-,溶液中水也发生电离,因此c(OH-)>c(H2CO3),故正确;C、加水稀释,c(Na+)、c(HCO3-)、c(CO32-)、c(OH-)减小,水的离子积不变,即c(H+)增大,故错误;D、根据物料守恒,2c(X)+2c(Y)+2c(Z)=c(Na+),故错误。
H2CO3+OH-,水解程度微弱,即X为HCO3-,Y为H2CO3,Z为CO32-,溶液中水也发生电离,因此c(OH-)>c(H2CO3),故正确;C、加水稀释,c(Na+)、c(HCO3-)、c(CO32-)、c(OH-)减小,水的离子积不变,即c(H+)增大,故错误;D、根据物料守恒,2c(X)+2c(Y)+2c(Z)=c(Na+),故错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铬同铁、钴、镍、铜等金属形成的合金,用于航空、宇航、电器、仪表及高端科技领域。
(1)铬的基态原子的价电子层排布式是__________________;
(2)氯化铬酰(CrO2Cl2)的熔点为-96.5℃,沸点为117℃,固态氯化铬酰属于_______晶体。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑,COCl2分子中σ键和π键的个数比为_____,空间构型为_______;CCl4的中心原子杂化类型为________,其等电子体为___________(写出一个离子形式);
(3)某镍配合物结构如下图所示。
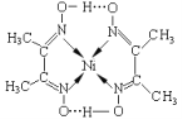
分子内含有的作用力有_________________(填序号),其中属于第二周期元素的第一电离能由大到小的顺序是_____________(填元素符号);
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为___________________;
(5)CoCl3·4NH3中心原子Co3+配位数为6,向含0.1 mol CoCl3·4NH3的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全共消耗50 mL溶液,则该配合物的化学式为________________;
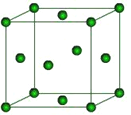
(6)下图是Fe的晶体一种堆积方式,若晶胞的边长为a pm,则晶体的密度为_______g·cm-3(用含a和NA的表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·江苏化学,18,12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2===MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化________L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为________。
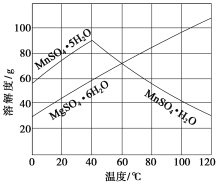
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制的结晶温度范围为________________________。
(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大。

(1)W位于元素周期表中第 周期第 族画出X的阴离子的结构示意图 。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式);Z的氢化物与氟化氢相比,沸点较高的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, (写化学式)的金属性强,请用实验证明它们金属性的相对强弱: 。
(4)写出Y的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物发生反应的化学反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
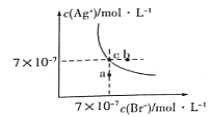
A.图中a点对应的是AgBr的不饱和溶液
B.在t °C时,AgBr的Ksp为 4.9×10-13
C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D.在t °C时,AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)的平衡常数K≈816
AgBr(s)+C1- (aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·江苏化学,14,4分)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10 mol·L-1 NH4HCO3溶液中通CO2:c(NH![]() )=c(HCO
)=c(HCO![]() )+c(CO
)+c(CO![]() )
)
B.向0.10 mol·L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH![]() )>c(SO
)>c(SO![]() )
)
C.向0.10 mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO![]() )+c(HSO
)+c(HSO![]() )+c(H2SO3)]
)+c(H2SO3)]
D.向0.10 mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将化合物A的蒸气2 mol充入0.5 L容器中加热,发生分解反应2A(g) ![]() B(g)+nC(g),反应到3 min时,容器中A的浓度为1.6 mol·L-1,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2 mol·L-1·min-1。
B(g)+nC(g),反应到3 min时,容器中A的浓度为1.6 mol·L-1,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2 mol·L-1·min-1。
(1)化学方程式中的化学计量数n的值是__________。
(2)以B的浓度变化表示的该反应的平均速率为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com