
����Ŀ����t��Cʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��CʱAgCl��Ksp=4��10-10������˵������ȷ����( )
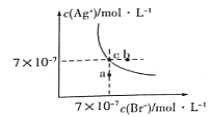
A��ͼ��a���Ӧ����AgBr�IJ�������Һ
B����t ��Cʱ��AgBr��KspΪ 4.9��10-13
C����AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
D����t ��Cʱ��AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)��ƽ�ⳣ��K��816
AgBr(s)+C1- (aq)��ƽ�ⳣ��K��816
���𰸡�C
��������
���������A������ͼ���֪����a��ʱQc=c(Ag+)c(Br-)��Ksp������a��ΪAgBr�IJ�������Һ����A��ȷ��B�����ͼ��c���c(Ag+)��c(Br-)��֪�����¶���AgBr��Ksp=7��10-7��7��10-7=4.9��10-13����B��ȷ��C����AgBr������Һ�м���NaBr�����c(Br-)�����ܽ�ƽ�������ƶ���c(Ag+)��С����C����D����ӦAgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)��ƽ�ⳣ��Ϊ��K=![]() =
=![]() ��816����D��ȷ����ѡC��
��816����D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼA��B��C�����ձ��зֱ�ʢ����ͬ���ʵ���Ũ�ȵ�ϡ���ᡣ
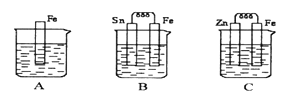
��1��A�з�Ӧ�����ӷ���ʽΪ____________��B��Sn����������ֵ�����_________________��C��ZnƬ�ϵĵĵ缫��ӦʽΪ________������__________��Ӧ���������Ӧ����ԭ��Ӧ������
��2��A��B��C�����ܽ�������ɿ쵽����˳����_________________ ��
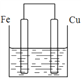
��3������������ȵ���Ƭ��ͭƬ�õ���������������ͭ��Һ�й���ԭ��أ���ͼ��������_________����������Ԫ�ط��ţ���һ��ʱ������缫�������1.2g��������ͨ���ĵ��ӵ����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����HNO3��HF�Ļ��ᴦ��ij������������ϴ��Һ�к���Fe3+��Ni2+��NO3-��F-��Cr2O72-�ȡ���ͼ���ۺ����ø���ϴ��Һ�Ĺ������̣�
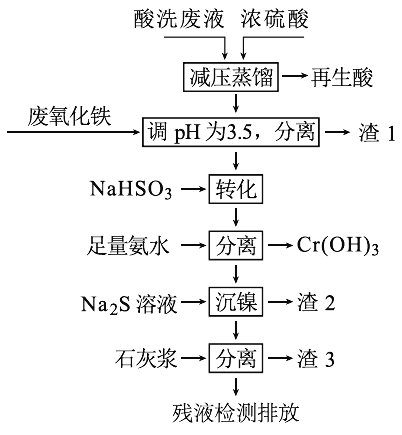
��֪��
�������ӿ�ʼ�����ͳ�����ȫʱ��pH��
Fe3+ | Ni2+ | Cr3+ | |
��ʼ���� | 1.5 | 6.7 | 4.0 |
������ȫ | 3.4 | 9.5 | 6.9 |
��Ni2+��������ˮ�ķ�ӦΪ��Ni2+��6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
��1���������к���HNO3,��ȡ��ѹ�����Ŀ��Ϊ____________��
��2������������Ҫ�ɷ�Ϊ��____________��
��3����д����ת����ʱNaHSO3��Cr2O72-������Ӧ���������뻹ԭ�������ʵ���֮�ȣ�________��
��4����֪[Ni(NH3)6]2+Ϊ�ѵ����������ӣ������������ӷ���ʽΪ��____________��
��5������3����Ҫ�ɷ�ΪCaSO4��Ca(OH)2��_____��
��6������⣬���IJ�Һ��c(Ca2+)��0.001 molL-1�����Һ��F��Ũ��Ϊ____mgL-1��______������ϡ������ϡ����ŷű�[��֪Ksp(CaF2)=4��10-11�������ŷű�Ҫ�������Ũ��С��10 mgL-1]��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijˮ��Һ�����ܺ��������������������֣�K����NH4+��Cl����Mg2����Ba2����CO32����SO42������ȡ����100 mL��Һ��������ʵ�飺
�ٵ�һ�ݼ�����NaOH��Һ���Ⱥ��ռ�������0.05 mol��
�ڵڶ��ݼ�����BaCl2��Һ�ø������4.3 g������������ϴ�ӡ������������Ϊ2.33 g������˵����ȷ����
A. K��һ������
B. ��Һ��c(Cl��)����Ϊ0.2 mol/L
C. Cl�����ܴ���
D. Ba2��һ�������ڣ�Mg2�����ܴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫ��У������.2017���㽭ʡ��������ѧУ����3��ѡ���������£�0.2 moI��L-l��Na2CO3��Һ��0.2 moI��L-l������������Ϻ�������Һ�в����������Ũ�ȵĹ�ϵ��ͼ��ʾ��X��Y��Z����ʾ��̼��������˵����ȷ����
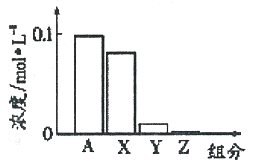
A. A����Na+Ũ��
B. ����Һ��c(OH-)>c(Y)
C. �����Һ�м�ˮϡ�ͣ���������Ũ�Ⱦ���С
D. �û����Һ�У�c(X)+c(Y)+c(Z)=2c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȫ��ʡ������.������ʡ���н���������2017������߿�ģ�����⣨һ��������˵����ȷ����
A. KAl(SO4)2��Һ�� c(K+)= 2c(SO42-)
B. ��NaHCO3��Һ�м������� Ba(OH)2���壬c(CO32-)����
C. ����AgCl��AgBr���������Һ�У�C(Ag+)>c(Cl-) =c(Br-)
D. �����£���0.1molCH3COOH����Һ�м���amolNaOH���壬��Ӧ����Һ��c(CH3COOH) =c(CH3COO-)������Һ�Լ��ԡ�����֪����Ka =1.75��10-5 )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����������÷�Һ©���ֿ����ǣ������Ȼ�̼��ˮ ���Ҵ������� �� �Ҵ���ˮ ������ˮ �����顢ˮ �������顢�� ���屽��ˮ
A���ڢۢ� B���٢ڢ� C���٢ܢݢ� D���ܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2014���������ۣ�11��6��)�����£����й�ϵ��ȷ����( )
A��Na2S��Һ��c(Na��)>c(HS��)>c(OH��)>c(H2S)
B��Na2C2O4��Һ��c(OH��)��c(H��)��c(HC2O![]() )��2c(H2C2O4)
)��2c(H2C2O4)
C��Na2CO3��Һ��c(Na��)��c(H��)��2c(CO![]() )��c(OH��)
)��c(OH��)
D��CH3COONa��CaCl2�����Һ��c(Na��)��c(Ca2��)��c(CH3COO��)��c(CH3COOH)��2c(Cl��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ�Ҳ��һ�����ʵ�ȼ�ϡ�
��.�״�������ȡ��ȩ��ԭ��ΪCH3OH(g)![]() HCHO(g) +H2(g)��ij����С����2 L�ܱ������г���1 mol CH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ��
HCHO(g) +H2(g)��ij����С����2 L�ܱ������г���1 mol CH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ��
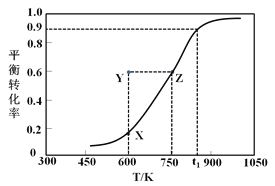
��1������ѡ���У���˵���÷�Ӧ�ﵽƽ��״̬����__________��
a��v(CH3OH) =v(HCHO) b��H2������������ٱ仯
c����ȩ�������������ٸı� d����������ܶȲ���
��2����t1ʱ���÷�Ӧ��ƽ�ⳣ��ΪK=________________�����¶��£��ӷ�Ӧ��ʼ��ƽ����������ʱ��Ϊ5 s����v(HCHO)Ϊ_______mol/(L��min)�������������ͨ��1.1 mol CH3OH��1.1 mol H2����ƽ����_________�������Ӧ�����淴Ӧ���������ƶ���
��3��600 Kʱ��Y��״���v(��)_______v(��) (�>������<����=��)��������_____________________��
��.��֪��CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ��H1=��a kJ/mol��
2Cu(s)+O2(g)=2CuO(s) ��H2=��b kJ/mol��
��4������ͭ������ʱ��2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ��H3=______kJ/mol���ú�a��b�Ĵ���ʽ��ʾ����
��.��ͼ��ʾ����NaOH��ҺΪ�������Һ�ļ״�ȼ�ϵ�أ�

��5��a���缫��ӦʽΪ__________________________������ĤΪ�����ӽ���Ĥ�����ع���һ�κ�ظ�������Һ��n(OH��)_____�����������С�����䡱����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com