
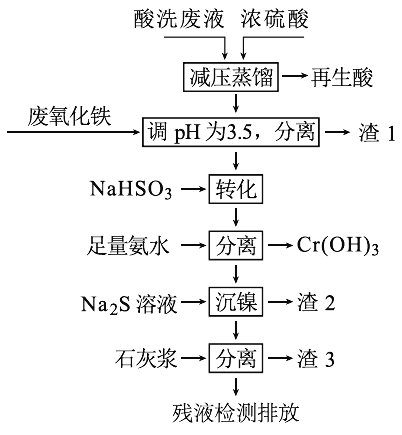
【题目】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下图是综合利用该酸洗废液的工艺流程:
已知:
金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为____________,
(2)滤渣1的主要成份为:____________。
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:____________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和_____。
(6)经检测,最后的残液中c(Ca2+)=0.001 molL-1,则残液中F-浓度为____mgL-1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL-1]。
【答案】 降低蒸馏的温度以减少酸的分解 Fe(OH)3 1:3 [Ni(NH3)6]2++S2-=NiS↓+6NH3 CaF2 3.8 符合
【解析】试题分析:
酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-,加入浓硫酸减压蒸馏,可以使低沸点的酸硝酸挥发出来;Fe3+完全沉淀的PH为3.4,所以加入氧化铁调节PH为3.5,可分离出Fe(OH)3;NaHSO3具有还原性,加入NaHSO3把具有氧化性的Cr2O72-还原为Cr3+;加入足量氨水Cr3+生成Cr(OH)3析出,Ni2+与足量氨水反应生成[Ni(NH3)6]2+,沉镍是把[Ni(NH3)6]2+转化为NiS沉淀;最后溶液中有大量F-,加入石灰浆可生成CaF2沉淀。
解析:(1)HNO3易分解,采取减压蒸馏的目的为降低蒸馏的温度以减少酸的分解;
(2)Fe3+完全沉淀的PH为3.4,所以加入氧化铁调节PH为3.5,析出的滤渣1的主要成份为Fe(OH)3。
(3) NaHSO3与Cr2O72-发生反应的方程式为3HSO3-+Cr2O72-+5H+= 2Cr3++ 3SO42-+4H2O,Cr2O72-是氧化剂,HSO3-是还原剂,物质的量之比1:3。
(4)沉镍是把[Ni(NH3)6]2+转化为NiS沉淀,离子方程式为:[Ni(NH3)6]2++S2-=NiS↓+6NH3 。
(5)由于溶液含有F-,滤渣3的主要成分为CaSO4、Ca(OH)2和CaF2。
(6)![]()
![]() ,则残液中F-浓度为
,则残液中F-浓度为![]()
![]() =3.8 mgL-1,所以符合排放标准。
=3.8 mgL-1,所以符合排放标准。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】[2015广东]化学是你,化学是我,化学深入我们生活。下列说法正确的是
A.木材纤维和土豆淀粉遇碘水均显蓝色
B.食用花生油和鸡蛋清都能发生水解反应
C.包装用材料聚乙烯和聚氯乙烯都属于烃
D.PX项目的主要产品对二甲苯属于饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
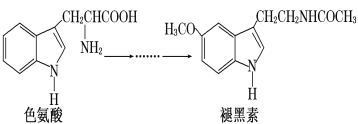
下列说法不正确的是
A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
B.在色氨酸水溶液中,可通过调节溶液的 pH 使其形成晶体析出
C.褪黑素与色氨酸结构相似,也具有两性化合物的特征反应
D.在一定条件下,色氨酸可发生加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高
D. 当杠杆为导体时,A端高B端低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬同铁、钴、镍、铜等金属形成的合金,用于航空、宇航、电器、仪表及高端科技领域。
(1)铬的基态原子的价电子层排布式是__________________;
(2)氯化铬酰(CrO2Cl2)的熔点为-96.5℃,沸点为117℃,固态氯化铬酰属于_______晶体。制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑,COCl2分子中σ键和π键的个数比为_____,空间构型为_______;CCl4的中心原子杂化类型为________,其等电子体为___________(写出一个离子形式);
(3)某镍配合物结构如下图所示。
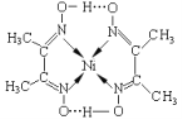
分子内含有的作用力有_________________(填序号),其中属于第二周期元素的第一电离能由大到小的顺序是_____________(填元素符号);
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)向CuSO4溶液中通入氨气得到深蓝色溶液的离子方程式为___________________;
(5)CoCl3·4NH3中心原子Co3+配位数为6,向含0.1 mol CoCl3·4NH3的溶液中滴加2 mol·L-1 AgNO3溶液,反应完全共消耗50 mL溶液,则该配合物的化学式为________________;
(6)下图是Fe的晶体一种堆积方式,若晶胞的边长为a pm,则晶体的密度为_______g·cm-3(用含a和NA的表达式表示)。
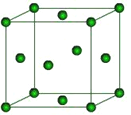
查看答案和解析>>
科目:高中化学 来源: 题型:
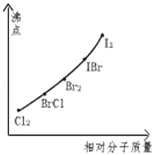
【题目】卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题:
(1)写出ICl的电子式 ,写出该物质与NaOH溶液反应的化学方程式
(2)卤素互化物BrCl能发生下列反应:KBr+BrCl=KCl+Br2,写出KI与IBr反应的化学方程式
(3)下图是部分卤素单质和xx,型卤素互化物的沸点与其相对分子质量的关系图.它们的沸点随着相对分子质量的增大而升高,其原因是 .
(4)试推测ICl的沸点所处于的最小范围 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·江苏化学,18,12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2===MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化________L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为________。
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制的结晶温度范围为________________________。
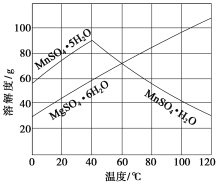
(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
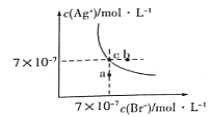
A.图中a点对应的是AgBr的不饱和溶液
B.在t °C时,AgBr的Ksp为 4.9×10-13
C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D.在t °C时,AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)的平衡常数K≈816
AgBr(s)+C1- (aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氧化二氮的摩尔质量是44g B. SO42-的摩尔质量是96g/mol
C. 1molO2的质量是32g/mol D. 铁的摩尔质量就是铁的相对原子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com