
【题目】褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到。
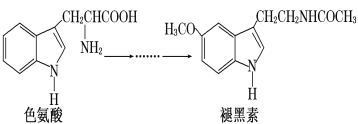
下列说法不正确的是
A.色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点
B.在色氨酸水溶液中,可通过调节溶液的 pH 使其形成晶体析出
C.褪黑素与色氨酸结构相似,也具有两性化合物的特征反应
D.在一定条件下,色氨酸可发生加聚反应
科目:高中化学 来源: 题型:
【题目】已知反应2A(g)+B(g) =C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A. ΔH<0,ΔS>0 B. ΔH<0,ΔS<0
C. ΔH>0,ΔS>0 D. ΔH>0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______,_________接受孤对电子对;金属铜的堆积方式为______。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________,COCl2分子中ɑ键和π键的个数比为__________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
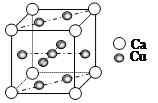
①该晶体的化学式为_________,铜和钙两种金属相比铜的熔点比钙高,其原因是_______。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
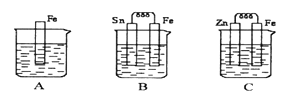
(1)A中反应的离子方程式为____________,B中Sn极附近会出现的现象_________________,C中Zn片上的的电极反应式为________,发生__________反应(填“氧化反应”或“还原反应”)。
(2)A、B、C中铁溶解的速率由快到慢的顺序是_________________ 。
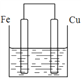
(3)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,电子由_________极流出(填元素符号),一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物有不同的分类方法,下列说法正确的是
①从组成元素分:烃,烃的衍生物 ②从分子中碳骨架形状分:链状有机化合物,环状有机化合物 ③从官能团分:烯烃、炔烃、芳香烃、卤代烃、醇、酚、醛、酮、羧酸、酯等
A. ①③ B. ①② C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。

(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下图是综合利用该酸洗废液的工艺流程:
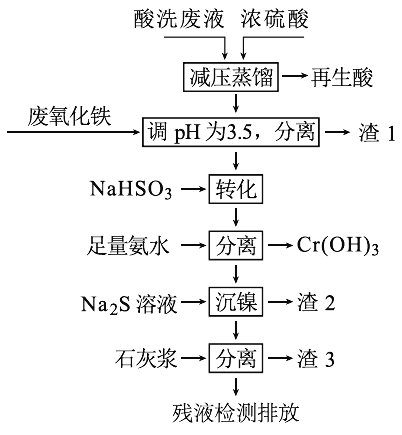
已知:
金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为____________,
(2)滤渣1的主要成份为:____________。
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:____________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和_____。
(6)经检测,最后的残液中c(Ca2+)=0.001 molL-1,则残液中F-浓度为____mgL-1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL-1]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物,不能用分液漏斗分开的是:①四氯化碳、水 ②乙醇、甘油 ③ 乙醇、水 ④苯、水 ⑤己烷、水 ⑥环己烷、苯 ⑦溴苯、水
A.②③⑥ B.①②③ C.①④⑤⑦ D.④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com