
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高
D. 当杠杆为导体时,A端高B端低
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于铁与稀硫酸反应的叙述不正确的是( )
A.属于置换反应
B.属于氧化还原反应
C.属于离子反应
D.1molFe参加反应失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
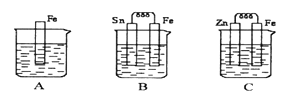
(1)A中反应的离子方程式为____________,B中Sn极附近会出现的现象_________________,C中Zn片上的的电极反应式为________,发生__________反应(填“氧化反应”或“还原反应”)。
(2)A、B、C中铁溶解的速率由快到慢的顺序是_________________ 。
(3)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,电子由_________极流出(填元素符号),一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为______mol。
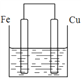
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物有不同的分类方法,下列说法正确的是
①从组成元素分:烃,烃的衍生物 ②从分子中碳骨架形状分:链状有机化合物,环状有机化合物 ③从官能团分:烯烃、炔烃、芳香烃、卤代烃、醇、酚、醛、酮、羧酸、酯等
A. ①③ B. ①② C. ①②③ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。

(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4 ⑨CO2;⑩酒精溶液(均填写编号回答)
(1)是弱电解质的有 ,是非电解质的有 。
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为 ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是 。
(3)某温度时,1 molL-1的醋酸溶液电离平衡常数为1.0×10 -8,达平衡时,溶液中氢离子浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下图是综合利用该酸洗废液的工艺流程:
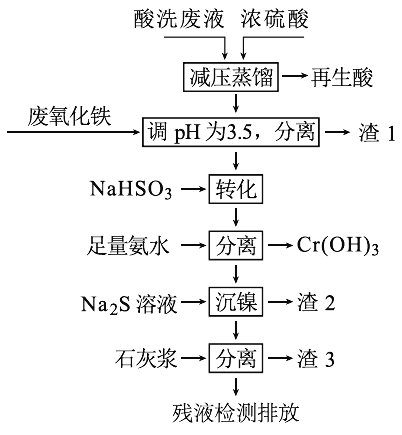
已知:
金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为____________,
(2)滤渣1的主要成份为:____________。
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:____________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和_____。
(6)经检测,最后的残液中c(Ca2+)=0.001 molL-1,则残液中F-浓度为____mgL-1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL-1]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
①第一份加足量NaOH溶液加热后,收集到气体0.05 mol;
②第二份加足量BaCl2溶液后,得干燥沉淀4.3 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。下列说法正确的是
A. K+一定存在
B. 溶液中c(Cl-)可能为0.2 mol/L
C. Cl-可能存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·安徽理综,11,6分)室温下,下列关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO![]() )+c(OH-)
)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com