
【题目】下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4 ⑨CO2;⑩酒精溶液(均填写编号回答)
(1)是弱电解质的有 ,是非电解质的有 。
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为 ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是 。
(3)某温度时,1 molL-1的醋酸溶液电离平衡常数为1.0×10 -8,达平衡时,溶液中氢离子浓度是 。
【答案】(1)③⑥(1分),⑨(1分)
(2)④>⑦>⑧(1分),a﹤b=c(1分)。
(3)1×10-4molL-1(2分)
【解析】
试题分析:(1)电解质为:在水溶液或熔融状态下能够导电的化合物,满足该条件的有①NaCl;②NaOH;③NH3H2O;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4;其中③NH3H2O和⑥H2O为弱电解质;非电解质为:在水溶液和熔融状态下都不导电的化合物,满足该条件下有:⑨CO2;
(2)醋酸是一元弱酸,盐酸是一元强酸,硫酸是二元强酸,pH相同时,醋酸浓度大于盐酸,盐酸浓度大于硫酸;pH相同时,氢离子浓度相同,醋酸不完全电离,醋酸浓度远远大于盐酸和硫酸,若分别用pH相等的这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积醋酸<盐酸=硫酸;
(3)醋酸的电离方程式为:CH3COOH![]() H++CH3COO-,其平衡常数表达式为K=
H++CH3COO-,其平衡常数表达式为K=![]() ;在1 molL-1的醋酸溶液中可令c(H+)=c(CH3COO-),则c(H+)=
;在1 molL-1的醋酸溶液中可令c(H+)=c(CH3COO-),则c(H+)=![]() mol/L=1.0×10-4mol/L。
mol/L=1.0×10-4mol/L。


科目:高中化学 来源: 题型:
【题目】维生素类药物中间体G(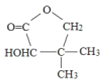 ),可按如下线路含成:
),可按如下线路含成:
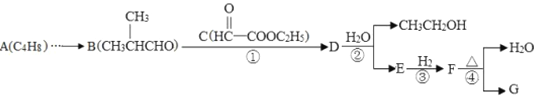
其中A~G分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知: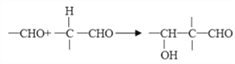
完成下列填空:
(1)A的名称是__________________,F的官能团_________________。
(2)写反应类型:反应①______________,②______________。
(3)G可以转化为化合物M(C6H10O),写出满足下列条件的2种M的结构简式:______、_______。
①分子中除羟基外还有一种碳碳不饱和键;②链状且不存在![]() 结构;
结构;
③分子中只有3种不同化学环境的氢原子。
(4)设计一条由A制备B的合成路线。_____________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.反应物中,氧化剂是;化合价升高的元素是 . 反应中HCl的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A. 杠杆为导体或绝缘体时,均为A端高B端低
B. 杠杆为导体或绝缘体时,均为A端低B端高
C. 当杠杆为导体时,A端低B端高
D. 当杠杆为导体时,A端高B端低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被还原和被氧化的氮元素的质量比是( )
A. 3:2 B. 2:1 C. 1:1 D. 2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题:
(1)写出ICl的电子式 ,写出该物质与NaOH溶液反应的化学方程式
(2)卤素互化物BrCl能发生下列反应:KBr+BrCl=KCl+Br2,写出KI与IBr反应的化学方程式
(3)下图是部分卤素单质和xx,型卤素互化物的沸点与其相对分子质量的关系图.它们的沸点随着相对分子质量的增大而升高,其原因是 .
(4)试推测ICl的沸点所处于的最小范围 .
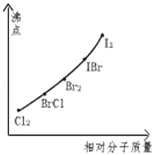
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:C________、D________、F________。
(2)E在元素周期表中的位置:______________________________。
(3)A、B组成的最简单化合物的结构式是_________________。
(4)C、D按原子个数比1∶1组成的一种化合物与A、E按原子个数比2∶1组成的一种化合物发生反应的化学方程式为_________________________。
(5)能说明E的非金属性比F的非金属性_______(填“强”或“弱”)的事实是:________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。有关反应的热化学方程式如下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)= H2O(l)△H=-44kJ/mol
I.写出CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:_________________。
II. 工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ/mol。为研究该反应平衡时CO转化率与反应物投料比(反应物投料比=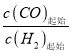 )以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
)以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
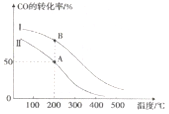
回答下列问题:
(1)反应热a____0(填“>”或“<”),判断理由是______。
(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①反应物投料比I_____II(填“>”或“<” 或“=”)。
②若按曲线II反应,n(CO)起始=10mol,反应物投料比=0.5,则A点的平衡常数(Ka)值为____,B点的平衡常数(Kb)值为________________。
(3)为提高CO的转化率,除了可以适当改变反应物与生成物的浓度外,还可以采取的措施有:________________、_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com