
【题目】【全国省级联考.东北三省四市教研联合体2017届高三高考模拟试题(一)】下列说法正确的是
A. KAl(SO4)2溶液中 c(K+)= 2c(SO42-)
B. 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大
C. 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-) =c(Br-)
D. 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH) =c(CH3COO-),则溶液显碱性。(已知醋酸Ka =1.75×10-5 )
【答案】B
【解析】A 项, 根据电荷守恒KAl(SO4)2溶液中 c(K+)+3c(Al3+)= 2c(SO42-),故A项错误;B项,向NaHCO3溶液中加入少量 Ba(OH)2固体,反应离子方程式为2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-,所以c(CO32-)增大,故B项正确;C项,悬浊液中AgCl和AgBr均达到沉淀溶解平衡,Ksp(AgCl)=C(Ag+)c(Cl-),Ksp(AgBr) =C(Ag+)c(Br-),因为Ksp(AgCl)≠Ksp(AgBr) ,所以c(Cl-)≠c(Br-),故C项错误;D项,c(CH3COOH) =c(CH3COO-),常温下根据电离常数 Ka=1.75×10-5和Ka=![]() 可得:c(H+)=Ka=1.75×10-5>10-7,所以溶液显酸性,故D项错误。综上所述,符合题意的选项为B。
可得:c(H+)=Ka=1.75×10-5>10-7,所以溶液显酸性,故D项错误。综上所述,符合题意的选项为B。
【名师点评】:本题考查电解质溶液,涉及电荷守恒、与量有关的反应、沉淀溶解平衡和电离常数等知识,题目难度一般。注意与量有关的反应常用定“1”法分析,如NaHCO3和少量 Ba(OH)2反应,把 Ba(OH)2前面化学计量数暂定为“1”,则1molBa(OH)2要消耗2molNaHCO3生成1molBaCO3、2molH2O和1molNa2CO3。


科目:高中化学 来源: 题型:
【题目】在实验室里用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.反应物中,氧化剂是;化合价升高的元素是 . 反应中HCl的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题:
(1)写出ICl的电子式 ,写出该物质与NaOH溶液反应的化学方程式
(2)卤素互化物BrCl能发生下列反应:KBr+BrCl=KCl+Br2,写出KI与IBr反应的化学方程式
(3)下图是部分卤素单质和xx,型卤素互化物的沸点与其相对分子质量的关系图.它们的沸点随着相对分子质量的增大而升高,其原因是 .
(4)试推测ICl的沸点所处于的最小范围 .
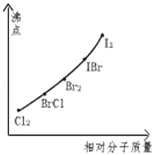
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:C________、D________、F________。
(2)E在元素周期表中的位置:______________________________。
(3)A、B组成的最简单化合物的结构式是_________________。
(4)C、D按原子个数比1∶1组成的一种化合物与A、E按原子个数比2∶1组成的一种化合物发生反应的化学方程式为_________________________。
(5)能说明E的非金属性比F的非金属性_______(填“强”或“弱”)的事实是:________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t°C时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t°C时AgCl的Ksp=4×10-10,下列说法不正确的是( )
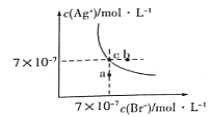
A.图中a点对应的是AgBr的不饱和溶液
B.在t °C时,AgBr的Ksp为 4.9×10-13
C.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
D.在t °C时,AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)的平衡常数K≈816
AgBr(s)+C1- (aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED系列产品是被看好的一类节能新产品,如图是一种氢氧燃料电池驱动LED发光的装置.下列有关叙述正确的是( )
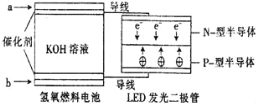
A.a处通入氢气,发生了还原反应:H2﹣2e﹣+2OH﹣=2H2O
B.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
C.b处通入氧气,为电池的正极
D.P﹣型半导体连接的是电池负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
(1)氢气在O2中燃烧的反应是______热反应(填“放”或“吸”),这是由于反应物的总能量______生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,氢气的燃烧是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量。已知破坏1mol H-H键、1mol O=O键、1mol H-O键时分别需要吸收a kJ、b kJ、c kJ的能量。则2mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为
____________________kJ。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池.该电池的正极是___(填a或b),负极反应式为______________。
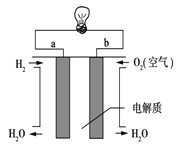
(4)若将右图中的氢氧燃料电池用固体金属氧化物陶瓷作电解质(能够传导O2-),已知正极上发生的电极反应式为:O2+4e-===2O2-则负极上发生的电极反应式为________;电子从________极(填a或b)流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。有关反应的热化学方程式如下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)= H2O(l)△H=-44kJ/mol
I.写出CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:_________________。
II. 工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ/mol。为研究该反应平衡时CO转化率与反应物投料比(反应物投料比=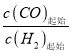 )以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
)以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
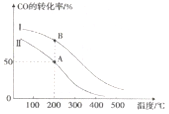
回答下列问题:
(1)反应热a____0(填“>”或“<”),判断理由是______。
(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①反应物投料比I_____II(填“>”或“<” 或“=”)。
②若按曲线II反应,n(CO)起始=10mol,反应物投料比=0.5,则A点的平衡常数(Ka)值为____,B点的平衡常数(Kb)值为________________。
(3)为提高CO的转化率,除了可以适当改变反应物与生成物的浓度外,还可以采取的措施有:________________、_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com