
【题目】下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
科目:高中化学 来源: 题型:
【题目】【全国省级联考.东北三省四市教研联合体2017届高三高考模拟试题(一)】下列说法正确的是
A. KAl(SO4)2溶液中 c(K+)= 2c(SO42-)
B. 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大
C. 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-) =c(Br-)
D. 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH) =c(CH3COO-),则溶液显碱性。(已知醋酸Ka =1.75×10-5 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下在固定容器中进行的可逆反应2M(g)+N(g)![]() Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
A.密度增大 B.平均相对分子质量增大 C总分子数增大 D.平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表第三周期中,置换酸中氢能力最强的元素的元素符号为_____,最高价氧化物对应水化物的酸性最强的化合物的化学式是__________,碱性最强的化合物的化学式是__________,显两性的氢氧化物的化学式是__________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为__________________、_________________,原子半径最大的金属元素的名称是________,离子半径最小的离子结构示意图是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,也是一种优质的燃料。
Ⅰ.甲醇脱氢制取甲醛的原理为CH3OH(g)![]() HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
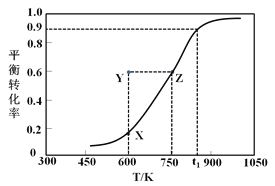
(1)下列选项中,能说明该反应达到平衡状态的是__________;
a.v(CH3OH) =v(HCHO) b.H2的体积分数不再变化
c.甲醛的质量分数不再改变 d.混合气体密度不变
(2)在t1时,该反应的平衡常数为K=________________,此温度下,从反应开始到平衡所经过的时间为5 s,则v(HCHO)为_______mol/(L·min)。向此容器中再通入1.1 mol CH3OH和1.1 mol H2,则平衡向_________(填“正反应”或“逆反应”)方向移动;
(3)600 K时,Y点甲醇的v(正)_______v(逆) (填“>”、“<”或“=”),理由是_____________________;
Ⅱ.已知:CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ΔH1=-a kJ/mol;
2Cu(s)+O2(g)=2CuO(s) ΔH2=-b kJ/mol;
(4)则在铜作催化剂时:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH3=______kJ/mol(用含a,b的代数式表示);
Ⅲ.如图所示是以NaOH溶液为电解质溶液的甲醇燃料电池:

(5)a极电极反应式为__________________________,若隔膜为阴离子交换膜,则电池工作一段后,电池负极区溶液中n(OH-)_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应2SO2 + O2![]() 2SO3,已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为2 mol·L-1 、1mol·L-1 、2mol·L-1。当反应达到平衡时,容器内各物质的浓度可能为
2SO3,已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为2 mol·L-1 、1mol·L-1 、2mol·L-1。当反应达到平衡时,容器内各物质的浓度可能为
A. SO2为4 mol·L-1、 O2为2 mol·L-1 B. SO3为4 mol·L-1
C. SO2为2.5 mol·L-1 D. SO2 、SO3为1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着环境污染的加重和人们环保意识的加强,生物降解材料逐渐受到了人们的关注。以下是PBA (—种生物降解聚酯高分子材料)的合成路线:

己知:①烃A的相对分子质量为84,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色。
②化合物C中只含一个官能团。
③R1CH=CHR2![]() R1COOH+R2COOH
R1COOH+R2COOH
④
(1)由A生成B的反应类型为_________。
(2)由B生成C的化学方程式为__________。
(3)E的结构简式为______________________。
(4)F的名称为______________(用系统命名法);由D和生成PBA的化学方程式为_______________;若PBA的平均聚合度为70,则其平均相对分子质量为___________。
(5)E的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①链状化合物 ②能发生银镜反应 ③氧原子不与碳碳双键直接相连
其中,核磁共振氢谱显示为2组峰,且峰面积比为2:1的是_________(写结构简式)。
(6)若由1.3—丁二烯为原料(其他无机试剂任选)通过三步制备化合物F,其合成路线为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如右下图所示。

(1)基态Ti原子的价电子轨道表示式为 。
(2)NaH的熔点为800℃,不溶于有机溶剂。NaH属于 晶体,其电子式为 。
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为 (标明配位键)。
(4)AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的两种离子 (填化学式)。
(5)NaAlH4晶体中,与Na+紧邻且等距的AlH4-有 个;NaAlH4晶体的密度为 g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com