
【题目】随着环境污染的加重和人们环保意识的加强,生物降解材料逐渐受到了人们的关注。以下是PBA (—种生物降解聚酯高分子材料)的合成路线:

己知:①烃A的相对分子质量为84,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色。
②化合物C中只含一个官能团。
③R1CH=CHR2![]() R1COOH+R2COOH
R1COOH+R2COOH
④
(1)由A生成B的反应类型为_________。
(2)由B生成C的化学方程式为__________。
(3)E的结构简式为______________________。
(4)F的名称为______________(用系统命名法);由D和生成PBA的化学方程式为_______________;若PBA的平均聚合度为70,则其平均相对分子质量为___________。
(5)E的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①链状化合物 ②能发生银镜反应 ③氧原子不与碳碳双键直接相连
其中,核磁共振氢谱显示为2组峰,且峰面积比为2:1的是_________(写结构简式)。
(6)若由1.3—丁二烯为原料(其他无机试剂任选)通过三步制备化合物F,其合成路线为:___________________。
【答案】 取代 ![]() +NaOH
+NaOH![]()
![]() +NaBr + H2O HOCH2C
+NaBr + H2O HOCH2C![]() CCH2OH 1,4—丁二醇 nHOOC(CH2)4COOH + nHOCH2(CH2)2CH2OH
CCH2OH 1,4—丁二醇 nHOOC(CH2)4COOH + nHOCH2(CH2)2CH2OH![]() HO
HO![]() + (2n-1)H2O 14018 6 OHCCH2CH2CHO具体为:H2C=
+ (2n-1)H2O 14018 6 OHCCH2CH2CHO具体为:H2C=![]() 、HOCH2CH=CHCHO、CH2=
、HOCH2CH=CHCHO、CH2=![]()
OHCCH2CH2CHO、![]()
HCOOCH2CH=CH2 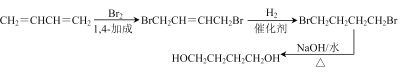
【解析】①烃A的相对分子质量为84,则A的分子式为C6H12,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色,则A为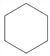 ,与液溴在光照条件下发生取代反应生成
,与液溴在光照条件下发生取代反应生成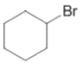 ,
,![]() 在NaOH的醇溶液中发生消去反应生成
在NaOH的醇溶液中发生消去反应生成![]() ,
,![]() 在酸性高锰酸钾溶液中氧化得到的D为HOOCCH2CH2CH2CH2COOH;
在酸性高锰酸钾溶液中氧化得到的D为HOOCCH2CH2CH2CH2COOH;![]() 与HCHO在一定条件下反应生成的E为
与HCHO在一定条件下反应生成的E为![]() ,E与H2发生加成反应生成的F为HOCH2CH2CH2CH2OH,D和F发生缩聚反应生成的PBA为
,E与H2发生加成反应生成的F为HOCH2CH2CH2CH2OH,D和F发生缩聚反应生成的PBA为![]() ;
;
(1)由 生成
生成![]() 的反应类型为取代反应;
的反应类型为取代反应;
(2)由![]() 在NaOH的醇溶液中发生消去反应生成
在NaOH的醇溶液中发生消去反应生成![]() 的化学方程式为
的化学方程式为![]() ;
;
(3)E的结构简式为![]() ;
;
(4)根据系统命名法,HOCH2CH2CH2CH2OH的名称为1,4—丁二醇 ;由HOOCCH2CH2CH2CH2COOH和HOCH2CH2CH2CH2OH发生缩聚反应生成PBA的化学方程式为nHOOC(CH2)4COOH + nHOCH2(CH2)2CH2OH![]() HO
HO![]() + (2n-1)H2O ;若PBA的平均聚合度为70,链节OC(CH2)4COOCH2(CH2)2CH2O的式量为200,则其平均相对分子质量为200×70+18=14018;
+ (2n-1)H2O ;若PBA的平均聚合度为70,链节OC(CH2)4COOCH2(CH2)2CH2O的式量为200,则其平均相对分子质量为200×70+18=14018;
(5) ①链状化合物,说明结构中无环;②能发生银镜反应说明有醛基;③氧原子不与碳碳双键直接相连;则可能是2个醛基,则有2种结构,具体为![]() ;也可能是一个碳碳双键,一个醇羟基与一个醛基,则有3种结构,具体为
;也可能是一个碳碳双键,一个醇羟基与一个醛基,则有3种结构,具体为![]() ;也可能是一个碳碳双键,一个甲酸酯,则有1种结构,具体是
;也可能是一个碳碳双键,一个甲酸酯,则有1种结构,具体是![]() ,共6种结构;其中,核磁共振氢谱显示为2组峰,且峰面积比为2:1的是OHCCH2CH2CHO;
,共6种结构;其中,核磁共振氢谱显示为2组峰,且峰面积比为2:1的是OHCCH2CH2CHO;
(6)由1.3—丁二烯通过三步制备化合物HOCH2CH2CH2CH2OH,其合成路线为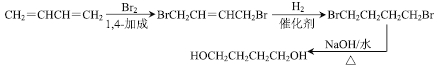 。
。


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
(1)氢气在O2中燃烧的反应是______热反应(填“放”或“吸”),这是由于反应物的总能量______生成物的总能量(填“大于”、“小于”或“等于”,下同);
(2)从化学反应的本质角度来看,氢气的燃烧是由于断裂反应物中的化学键吸收的总能量______形成产物的化学键放出的总能量。已知破坏1mol H-H键、1mol O=O键、1mol H-O键时分别需要吸收a kJ、b kJ、c kJ的能量。则2mol H2(g)和1mol O2(g)转化为2mol H2O(g)时放出的热量为
____________________kJ。
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,下图就是能够实现该转化的装置(其中电解质溶液为KOH溶液),被称为氢氧燃料电池.该电池的正极是___(填a或b),负极反应式为______________。
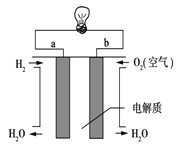
(4)若将右图中的氢氧燃料电池用固体金属氧化物陶瓷作电解质(能够传导O2-),已知正极上发生的电极反应式为:O2+4e-===2O2-则负极上发生的电极反应式为________;电子从________极(填a或b)流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
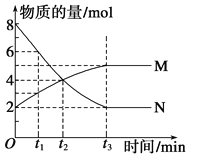
A. 反应的化学方程式:2M![]() N
N
B. t2时,正、逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CS2是极性键构成的极性分子
B.SO2与CO2为等电子体
C.金属晶体的六方最密堆积和面心立方最密堆积的方式空间利用率最高
D.1molNaHSO4熔融态时有3mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
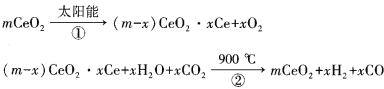
下列说法不正确的是( )
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—= CO32—+2H2O
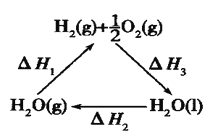
D.上图中△H1=△H2+△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.6 g碳在 6.4 g氧气中燃烧,至反应物耗尽,共放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为
A.-Y kJ/mol B.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/mol D.+(10X-Y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中用于半导体材料的元素在周期表中的位置是__________________。
(2)③、④、⑧的原子半径最小是___________________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是__________(用化学式回答)。
(4)②、③、④的气态氢化物,稳定性最强的是__________(用结构式回答
(5)②和③按原子数1:2形成的化合物的电子式为____________,该晶体气化的过程中克
服的微粒间作用力为_______________________。
(6)③和⑧形成的化合物属于_______________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Si有导电性,可用于制备光导纤维
B. Na2O2能与CO2反应,可用作呼吸面具的供氧剂
C. 硅胶常用作实验室和食品、药品等的干燥剂,也可作催化剂载体
D. 小苏打是一种膨松剂,可用于制作馒头和面包
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com