
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
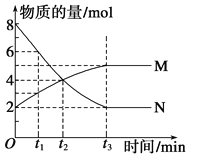
A. 反应的化学方程式:2M![]() N
N
B. t2时,正、逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时N的浓度是M浓度的2倍
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取两份100 mL溶液进行如下实验:
①第一份加足量NaOH溶液加热后,收集到气体0.05 mol;
②第二份加足量BaCl2溶液后,得干燥沉淀4.3 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。下列说法正确的是
A. K+一定存在
B. 溶液中c(Cl-)可能为0.2 mol/L
C. Cl-可能存在
D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·安徽理综,11,6分)室温下,下列关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO![]() )+c(OH-)
)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下在固定容器中进行的可逆反应2M(g)+N(g)![]() Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
A.密度增大 B.平均相对分子质量增大 C总分子数增大 D.平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 可以利用铝热反应冶炼高熔点的金属
B. 现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100%
C. 工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可
D. 煤直接液化可得液体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表第三周期中,置换酸中氢能力最强的元素的元素符号为_____,最高价氧化物对应水化物的酸性最强的化合物的化学式是__________,碱性最强的化合物的化学式是__________,显两性的氢氧化物的化学式是__________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为__________________、_________________,原子半径最大的金属元素的名称是________,离子半径最小的离子结构示意图是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,也是一种优质的燃料。
Ⅰ.甲醇脱氢制取甲醛的原理为CH3OH(g)![]() HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
HCHO(g) +H2(g)。某科研小组在2 L密闭容器中充入1 mol CH3OH,对该反应进行了一系列的研究,得到甲醇的平衡转化率随温度的变化曲线如图所示。
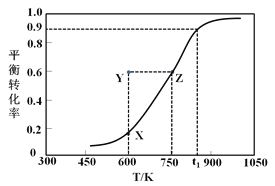
(1)下列选项中,能说明该反应达到平衡状态的是__________;
a.v(CH3OH) =v(HCHO) b.H2的体积分数不再变化
c.甲醛的质量分数不再改变 d.混合气体密度不变
(2)在t1时,该反应的平衡常数为K=________________,此温度下,从反应开始到平衡所经过的时间为5 s,则v(HCHO)为_______mol/(L·min)。向此容器中再通入1.1 mol CH3OH和1.1 mol H2,则平衡向_________(填“正反应”或“逆反应”)方向移动;
(3)600 K时,Y点甲醇的v(正)_______v(逆) (填“>”、“<”或“=”),理由是_____________________;
Ⅱ.已知:CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ΔH1=-a kJ/mol;
2Cu(s)+O2(g)=2CuO(s) ΔH2=-b kJ/mol;
(4)则在铜作催化剂时:2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ΔH3=______kJ/mol(用含a,b的代数式表示);
Ⅲ.如图所示是以NaOH溶液为电解质溶液的甲醇燃料电池:

(5)a极电极反应式为__________________________,若隔膜为阴离子交换膜,则电池工作一段后,电池负极区溶液中n(OH-)_____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着环境污染的加重和人们环保意识的加强,生物降解材料逐渐受到了人们的关注。以下是PBA (—种生物降解聚酯高分子材料)的合成路线:

己知:①烃A的相对分子质量为84,核磁共振氢谱显示只有1组峰,不能使溴的四氯化碳溶液褪色。
②化合物C中只含一个官能团。
③R1CH=CHR2![]() R1COOH+R2COOH
R1COOH+R2COOH
④
(1)由A生成B的反应类型为_________。
(2)由B生成C的化学方程式为__________。
(3)E的结构简式为______________________。
(4)F的名称为______________(用系统命名法);由D和生成PBA的化学方程式为_______________;若PBA的平均聚合度为70,则其平均相对分子质量为___________。
(5)E的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①链状化合物 ②能发生银镜反应 ③氧原子不与碳碳双键直接相连
其中,核磁共振氢谱显示为2组峰,且峰面积比为2:1的是_________(写结构简式)。
(6)若由1.3—丁二烯为原料(其他无机试剂任选)通过三步制备化合物F,其合成路线为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为A l3+的单体形态铝(用Ala表示)总浓度,主要为主要为[AlO4 Al12(OH)24(H2O)12 ]7+的中等聚合形态铝总浓度(用Alb 表示)和Al(OH)3胶体形态铝(用A1c表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)△H1=akJ·mol-1
②3AlCl(g)= 2Al(s)+AlCl3(g) △H2=bkJ·mol-1
则反应Al2O3(s)+33C(s)= 2Al(s)+ 3CO(g)△H=______kJ·mol-1(用含a、b的代数式表尔)。 反应①在常压、1900 ℃ 的高温下才能进行,说明△H______( 填“>”“=”或“<”)。
(1)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如下表:
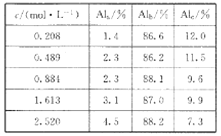
①在一定温度下,c越大,Al(OH)3胶体的百分含量______(填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氯化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_____________。
(3)一定条件下,向1.0mol/L的AlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86 % 的聚合氯化铝溶液。写出生成[AlO4 Al12(OH)24(H2O)12 ]7+的离子方程式:_______。
(4)已知Al3++4X=2![]() ,X表示显色剂,
,X表示显色剂, ![]() 表示有色物质,通过比色分析得到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194mol·L-1)。
表示有色物质,通过比色分析得到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194mol·L-1)。

①1min时, ![]() 的浓度为___________。
的浓度为___________。
②0~3min内该反应的速率vx=________。
③第9min时,反应达到平衡,K=__________(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com