
【题目】下列说法不正确的是
A. 可以利用铝热反应冶炼高熔点的金属
B. 现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100%
C. 工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可
D. 煤直接液化可得液体燃料
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
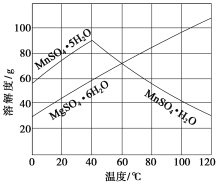
【题目】(2015·江苏化学,18,12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2===MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化________L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为________。
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制的结晶温度范围为________________________。
(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氧化二氮的摩尔质量是44g B. SO42-的摩尔质量是96g/mol
C. 1molO2的质量是32g/mol D. 铁的摩尔质量就是铁的相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g) ![]() CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是( )
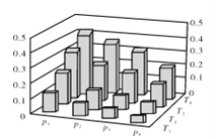
A.P1>P2>P3>P4
B.若T1> T2> T3>T4,则该反应为放热反应
C.甲醇的物质的量分数越高,反应的平衡常数越大
D.缩小容积,可以提高CH3OH在混合物中的质量分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
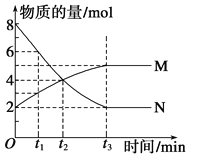
A. 反应的化学方程式:2M![]() N
N
B. t2时,正、逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将化合物A的蒸气2 mol充入0.5 L容器中加热,发生分解反应2A(g) ![]() B(g)+nC(g),反应到3 min时,容器中A的浓度为1.6 mol·L-1,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2 mol·L-1·min-1。
B(g)+nC(g),反应到3 min时,容器中A的浓度为1.6 mol·L-1,测得这段时间内,用C的浓度变化表示的平均反应速率v(C)=1.2 mol·L-1·min-1。
(1)化学方程式中的化学计量数n的值是__________。
(2)以B的浓度变化表示的该反应的平均速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法错误的是
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是

A. 电子从b流出,经外电路流向a
B. HS-在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-=SO42-+9H+
C. 如果将反应物直接燃烧,能量的利用率不会变化
D. 若该电池电路中有0.4mol电子发生转移,则有0.5molH+通过质子交换膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com