
【题目】下列属于碱的是
A.NH3·H2O B.MnO2 C.HNO3 D.NaHCO3
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中错误的是
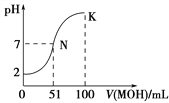
A. HA为一元强酸
B. MOH为一元弱碱
C. N点水的电离程度大于K点水的电离程度
D. K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酸式盐的水溶液一定显碱性
B.只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等
D.碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2A(g)+B(g) =C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A. ΔH<0,ΔS>0 B. ΔH<0,ΔS<0
C. ΔH>0,ΔS>0 D. ΔH>0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产氯化铜晶体的流程如下:

(1)反应Ⅰ中所加Zn粉不能过量的原因是______________________
(2)滤液Ⅱ中含有的主要金属阳离子是___________________
(3)写出反应Ⅱ的化学方程式____________________________________________________
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、__________、___________。
(5)在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是___________________________________________________(用化学方程式表示)
(6)CuCl2·xH2O晶体中x值的测定:称取3.420g产品溶解于适量水中,向其中加入含AgNO3 4.400×10-2mol的AgNO3溶液(溶液中除Cl- 外,不含其它与Ag+反应的离子),待Cl- 完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的KSCN标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定终点的现象是_______________________________________。
②若滴定过程用去上述浓度的KSCN标准溶液20.00mL,则CuCl2·xH2O中x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁与稀硫酸反应的叙述不正确的是( )
A.属于置换反应
B.属于氧化还原反应
C.属于离子反应
D.1molFe参加反应失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用微生物处理含KCN的废水。第一步是微生物在氧气充足的条件下,将KCN转化成KHCO3和NH3(最佳pH : 6.7~7.2);第二步是把氨转化为硝酸:NH3+202![]() HNO3+H2O
HNO3+H2O
请完成下列填空:
(1)写出第一步反应的化学反应方程式_____________,第二步反应的还原产物是_____________ (填写化学式)。
(2)在KCN中,属于短周期且原子半径最大的元素是_____,氮原子最外层电子的运动状态有_______种。水的电子式是________。
(3)比较碳和氮元素非金属性强弱,化学反应方程式为_____________。
(4)室握下,0.lmol/LK2CO3、KCN、KHCO3溶液均呈碱性且pH依次减小,在含等物质的量的KCN、KHCO3混合溶液中,阴离子(除OH-)浓度由大到小的顺序是_____________。
(5)工业上还常用氯氧化法处凡含KCN的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2→N2+6KCl+2CO2+2H2O。两扮相比,微生物处理法的优点与缺点是(各写一条)。
优点:________;缺点:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______,_________接受孤对电子对;金属铜的堆积方式为______。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________,COCl2分子中ɑ键和π键的个数比为__________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
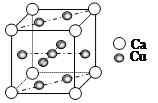
①该晶体的化学式为_________,铜和钙两种金属相比铜的熔点比钙高,其原因是_______。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的H2S通过高温热分解可制取氢气:2H2S(g)![]() 2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
2H2(g)+S2(g)。现在3L密闭容器中,控制不同温度进行H2S分解实验。
(1)某温度时,测得反应体系中有气体1.3lmol,反应1 min后,测得气体为l.37mol,则tmin 内H2的生成速率为___________。
(2)某温度时,H2S的转化率达到最大值的依据是_____________(选填编号)。
a.气体的压强不发生变化 b.气体的密度不发生变化
c.![]() 不发生变化 d.单位时间里分解的H2S和生成的H2一样多
不发生变化 d.单位时间里分解的H2S和生成的H2一样多
(3)实验结果如下图。图中曲线a表示H2S的平衡转化率与温度关系,曲线b表示不同温度下、反应经过相同时间且未达到化学平衡时H2S的转化率。该反应为_____反应(填“放热”或“吸热”)。曲线b随温度的升高,向曲线a通近的原因是_________。在容器体积不变的情况下,如果要提高H2的体积分数,可采取的一种措施是________。

(4)使1LH2S与20L空气(空气中O2体积分数为0.2)完全反应后恢复到室温,混合气体的体积是______L 。若2gH2S完全燃烧后生成二氧化硫和水蒸气,同时放出29.4 kJ的热量,该反应的热化学方程式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com