
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中错误的是
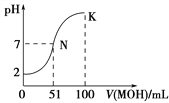
A. HA为一元强酸
B. MOH为一元弱碱
C. N点水的电离程度大于K点水的电离程度
D. K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol·L-1
【答案】D
【解析】A、起点时pH=2,c(H+)=10-2mol·L-1,HA的浓度为0.01mol·L-1,即HA为强酸,故说法正确;B、加入50mL的MOH时,两者恰好完全反应,此时溶液显酸性MA属于强酸弱碱盐,即MOH是弱碱,故说法正确;C、K点溶液中MOH的物质的量大于N点时MOH的物质的量,对水的电离抑制增强,故说法正确;D、K点溶质为MOH和MA,且两者物质的量相等,根据电荷守恒,得出c(M+)+c(H+)=c(A-)+c(OH-),根据物料守恒,c(M+)+c(MOH)=2c(A-),两式变形,得到c(MOH)+2c(OH-)-2c(H+)=c(M+),即c(MOH)+c(OH-)-c(H+)=c(M+)+c(H+)-c(OH-)=c(A-)=0.01/2mol·L-1=0.005mol·L-1,故说法错误。


科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJmol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJmol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
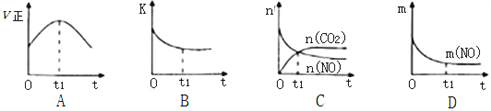
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与O2、F2均能发生反应,下图为H2与F2发生反应生成HF过程中的能量变化示意图。请回答
下列问题:
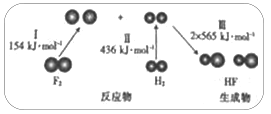
H2(g)与F2(g)反应生成HF(g)过程中的能量最变化
(1)完成转化I、II_________(填“吸收”或“放出”,下同)能量,完成转化Ⅲ_________能量。
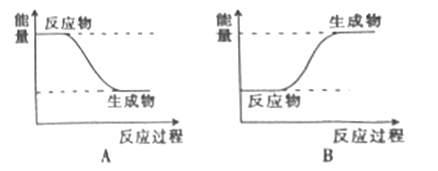
(2)H2和F2反应的能量变化图可用___________(填“A”或“B”)表示。
(3)H2在O2中燃烧的过程主要是__________能转化为_______能的过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016新课标Ⅱ]下列有关燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。


熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
(1)在烧瓶中混合有机物及浓硫酸的方法是___________________,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时。
(2)B装置的冷凝管的主要作用是_____________,可否换为球形冷凝管(填“可”或“否”)。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为_______________(填装置字母代号)。
(4)A中Na2CO3的作用是____________________;D装置的作用是___________________
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里有4个药品橱,已经存放以下物品:
药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
药品 | 盐酸,硫酸 | 氢氧化钠,氢氧化钙 | 红磷,硫 | 铜,锌 |
实验室新购进一些碘,应该将这些碘放在( )
A.甲橱
B.乙橱
C.丙橱
D.丁橱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) ![]() H2(g)+I2(g)△H<0
H2(g)+I2(g)△H<0
(1)该反应平衡常数的表达式为K=______________,则H2(g)+I2(g) ![]() 2HI(g)平衡常数的表达式为K1=_____________(用K表示)。
2HI(g)平衡常数的表达式为K1=_____________(用K表示)。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为________,HI的分解率为________。
(3)能判断该反应达到平衡状态的依据是________
A.容器中压强不变
B.混合气体中c(HI)不变
C.c(I2)=c(H2)
D.v(HI)正=v(H2)逆
(4)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的浓度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向_________(填“正向”或“逆向”,下同)进行,若升高温度,反应向_________进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com