
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g) ![]() H2(g)+I2(g)△H<0
H2(g)+I2(g)△H<0
(1)该反应平衡常数的表达式为K=______________,则H2(g)+I2(g) ![]() 2HI(g)平衡常数的表达式为K1=_____________(用K表示)。
2HI(g)平衡常数的表达式为K1=_____________(用K表示)。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为________,HI的分解率为________。
(3)能判断该反应达到平衡状态的依据是________
A.容器中压强不变
B.混合气体中c(HI)不变
C.c(I2)=c(H2)
D.v(HI)正=v(H2)逆
(4)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的浓度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向_________(填“正向”或“逆向”,下同)进行,若升高温度,反应向_________进行。
【答案】
(1)K=![]() ;K1=
;K1=![]() (4分)
(4分)
(2)0.5mol/L,20%(2分)
(3)BD(2分)
(4)正向,逆向(2分)
【解析】(1)化学平衡状态下,平衡常数为气态生成物浓度密之积比上气态反应物浓度密之积,K=![]() ,H2(g)+I2(g)
,H2(g)+I2(g) ![]() 2HI(g)是2HI(g)
2HI(g)是2HI(g) ![]() H2(g)+I2(g)的逆反应,化学平衡常数为原反应平衡常数的倒数,K1=
H2(g)+I2(g)的逆反应,化学平衡常数为原反应平衡常数的倒数,K1=![]() ,故答案为:K=
,故答案为:K=![]() ;K1=
;K1=![]() ;
;
(2)反应达到平衡时c(I2)=0.5mol/L,根据2HI(气)![]() H2(气)+I2(气)可知,c(H2)= 0.5mol/L,HI分解的浓度为2×0.5mol/L=1mol/L,反应达到平衡时c(HI)=4mol/L,HI 的分解率为
H2(气)+I2(气)可知,c(H2)= 0.5mol/L,HI分解的浓度为2×0.5mol/L=1mol/L,反应达到平衡时c(HI)=4mol/L,HI 的分解率为![]() ×100%=20%,故答案:0.5mol/L;20%;
×100%=20%,故答案:0.5mol/L;20%;
(3)A.该反应属于气体的物质的量不变的反应,容器中压强始终不变,错误;B.混合气体中c(HI)不变,表示达到了平衡状态,正确;C.c(I2)=c(H2),浓度不一定保持不变,不能说明达到了平衡状态,错误;D.v(HI)正=v(H2)逆,表示达到了平衡状态,正确;故选BD;
(4) 某时刻,Qc=![]() =
=![]() =
=![]() <1,反应向正反应方向进行,该反应正反应为吸热反应,升高温度,平衡逆向移动,故答案为:正向,逆向
<1,反应向正反应方向进行,该反应正反应为吸热反应,升高温度,平衡逆向移动,故答案为:正向,逆向


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】判断下列物质按碱性减弱、酸性增强的顺序依次排列正确的是
A.厨房清洁剂 肥皂 醋 厕所清洁剂
B.醋 厕所清洁剂 肥皂 厨房清洁剂
C.厕所清洁剂 醋 肥皂 厨房清洁剂
D.厨房清洁剂 厕所清洁剂 醋 肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中错误的是
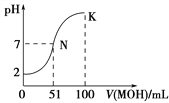
A. HA为一元强酸
B. MOH为一元弱碱
C. N点水的电离程度大于K点水的电离程度
D. K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述正确的是( )
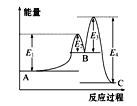
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的能量变化
D.整个反应中能量变化:ΔH=E1-E4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.化学的特征就是认识分子和制造分子
B.化学实验能解决化学学科的所有问题
C.研究物质的性质常运用观察、实验、分类、比较等方法
D.英国科学家道尔顿提出原子学说,为近代化学的发展奠定了坚实的基础
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酸式盐的水溶液一定显碱性
B.只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性
C.纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等
D.碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2A(g)+B(g) =C(g)+3D(g)的逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A. ΔH<0,ΔS>0 B. ΔH<0,ΔS<0
C. ΔH>0,ΔS>0 D. ΔH>0,ΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______,_________接受孤对电子对;金属铜的堆积方式为______。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________,COCl2分子中ɑ键和π键的个数比为__________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
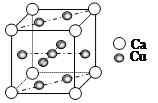
①该晶体的化学式为_________,铜和钙两种金属相比铜的熔点比钙高,其原因是_______。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com