
【题目】H2C2O4是一种二元弱酸,H2C2O4溶液中各型体浓度在其总浓度中所占比值叫其分布系数,常温下某浓度的H2C2O4溶液中各型体分布系数随pH的变化如图所示,据此分析,下列说法不正确的是
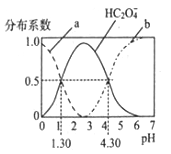
A. 曲线a代表H2C2O4,曲线b代表C2O42-
B. 常温下0.1mol/L的NaHC2O4溶液显酸性
C. 常温下,H2C2O4的电离平衡常数Ka2=10-4..30
D. pH从1.30~4.30时,  先增大后减小
先增大后减小
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产氯化铜晶体的流程如下:

(1)反应Ⅰ中所加Zn粉不能过量的原因是______________________
(2)滤液Ⅱ中含有的主要金属阳离子是___________________
(3)写出反应Ⅱ的化学方程式____________________________________________________
(4)“系列操作”包括蒸发浓缩、冷却结晶、过滤、__________、___________。
(5)在空气中直接加热CuCl2·xH2O晶体得不到纯的无水CuCl2,原因是___________________________________________________(用化学方程式表示)
(6)CuCl2·xH2O晶体中x值的测定:称取3.420g产品溶解于适量水中,向其中加入含AgNO3 4.400×10-2mol的AgNO3溶液(溶液中除Cl- 外,不含其它与Ag+反应的离子),待Cl- 完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的KSCN标准溶液滴定剩余的AgNO3。使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定终点的现象是_______________________________________。
②若滴定过程用去上述浓度的KSCN标准溶液20.00mL,则CuCl2·xH2O中x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用微生物处理含KCN的废水。第一步是微生物在氧气充足的条件下,将KCN转化成KHCO3和NH3(最佳pH : 6.7~7.2);第二步是把氨转化为硝酸:NH3+202![]() HNO3+H2O
HNO3+H2O
请完成下列填空:
(1)写出第一步反应的化学反应方程式_____________,第二步反应的还原产物是_____________ (填写化学式)。
(2)在KCN中,属于短周期且原子半径最大的元素是_____,氮原子最外层电子的运动状态有_______种。水的电子式是________。
(3)比较碳和氮元素非金属性强弱,化学反应方程式为_____________。
(4)室握下,0.lmol/LK2CO3、KCN、KHCO3溶液均呈碱性且pH依次减小,在含等物质的量的KCN、KHCO3混合溶液中,阴离子(除OH-)浓度由大到小的顺序是_____________。
(5)工业上还常用氯氧化法处凡含KCN的废水:KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2→N2+6KCl+2CO2+2H2O。两扮相比,微生物处理法的优点与缺点是(各写一条)。
优点:________;缺点:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,H2O的质量为xg,含有y个氢原子,则阿伏加德罗常数为( )
A.18y/x B.9y/x C.18y/ x mol-1 D.9y/x mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______,_________接受孤对电子对;金属铜的堆积方式为______。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________,COCl2分子中ɑ键和π键的个数比为__________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
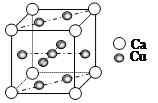
①该晶体的化学式为_________,铜和钙两种金属相比铜的熔点比钙高,其原因是_______。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
A. v(NH3)=2v(CO2) B. 密闭容器中混合气体的平均摩尔质量不变
C. 密闭容器中混合气体密度不变 D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如下:
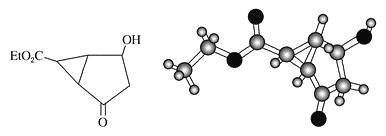
该有机分子的核磁共振氢谱图如下(单位是ppm)。
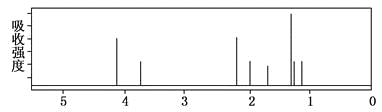
下列关于该有机物的叙述不正确的是
A. 该有机物不同化学环境的氢原子有8种
B. 该有机物与氢氧化钠的醇溶液共热时可以发生消去反应
C. 键线式中的Et代表的基团为—CH2CH3
D. 1mol该有机物最多可以与2mol NaOH反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com