
【题目】Zu1emaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
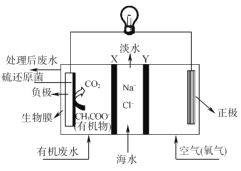
A.该装置可以在高温下工作
B.正极附近溶液的pH值减小
C.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D.该装置工作时,电能转化为化学能
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.常温下,0.1 mol·L-1CH3COONa溶液的pH=8,则该溶液中 c(CH3COOH)=(10-6-10-8)mol·L—1
B.对于相同浓度的弱酸HX和HY(前者的Ka较大)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值
C.硫酸钡固体在水中存在以下平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
D.常温下,a mol·L-1的CH3COOH溶液与0.01mol·L-1NaOH溶液等体积混合后溶液呈中性,此温度下醋酸的电离平衡常数Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
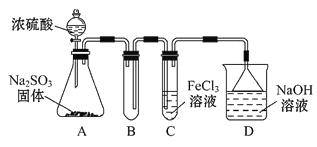
(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42。该做法_______(填“合理”或“不合理”),理由是____________。
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡苯脲是一种西瓜膨大剂(植物生长调节剂),其组成结构和物理性质见下表。
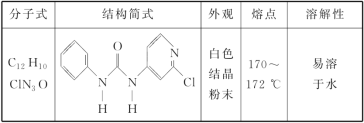
回答下列问题:
(1)氯吡苯脲晶体中,氮原子的杂化轨道类型为________。
(2)氯吡苯脲晶体中,微粒间的作用力类型有________。
A.离子键 B.金属键
C.极性键 D.非极性键
E.配位键 F.氢键
(3)查文献可知,可用2-氯-4-氨吡啶与异氰酸苯酯反应,生成氯吡脲。

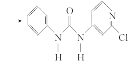
反应过程中,每生成1 mol氯吡苯脲,断裂________个σ键、断裂________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同条件下进行合成氨的反应(N2+3H2![]() 2NH3),根据下列在相同时间内测定的正反应速率判断,生成NH3的速率最快的是
2NH3),根据下列在相同时间内测定的正反应速率判断,生成NH3的速率最快的是
A. v(H2)=0.3 mol·L-1·min-1 B. v(N2)=0.2 mol·L-1·min-1
C. v(NH3)=0.3 mol·L-1·min-1 D. v(H2)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂碳、铝、铬是重要的元素,在工业生产和科技中有重要的应用。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_____________。
(2)金属锂是锂电池重要的组成部分。Li、Be、B 原子的第一电离能由大到小的顺序为______。
(3)LiAlH4是有机合成中常用的还原剂。AlH4-的空间构型为___________。
(4)![]() +
+
![]()
![]() +CH3COOH
+CH3COOH
①乙酸酐分子中碳原子轨道的杂化类型为________。
②l mol对甲基苯乙酮分子中含有的σ键的数目为_______
③甲苯分子难溶于水的原因是________。
(5)已知铬酸钙晶胞如图所示,该晶体密度为ρ g·cm-1,NA是阿伏加德罗常数的值。Ca离子周围距离最近且相等的O有_____个。相邻两个面心氧离子最短核间距(d)为_______pm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com