
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
科目:高中化学 来源: 题型:
【题目】二甲醚是一种绿色、可再生的新能源。如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法正确的是( )

A. a电极为该电池正极
B. O2在b电极上得电子,被氧化
C. 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O===2CO2↑+12H+
D. 电池工作时,燃料电池内部H+从b电极移向a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出ClO2,是一种高效的氧化剂和优质漂白剂,可用于各种纤维和某些食品的漂白。过氧化氢法制备NaClO2固体的实验装置如图所示:
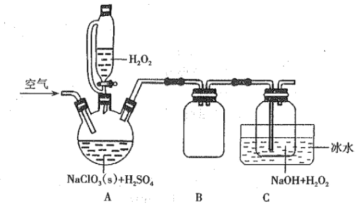
已知:
①ClO2的熔点为-59℃、沸点为11℃,极易溶于水,遇热水、见光易分解;气体浓度较大时易发生分解,若用空气、CO2、氮气等气体稀释时,爆炸性则降低。
②2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
请回答:
(1)按上图组装好仪器后,首先应该进行的操作是____;装置B的作用是___;冰水浴冷却的主要目的不包括_(填字母)。
a.减少H2O2的分解 b.降低ClO2的溶解度 c.减少ClO2的分解
(2)ClO2是合成NaClO2的重要原料,写出三颈烧瓶中生成ClO2的化学方程式: ____。
(3)装置C中加入NaOH溶液的目的除了作反应物外,还因为_____。空气的流速过慢或过快都会影响NaClO2的产率,试分析原因:________。
(4)该套装置存在的明显缺陷是_________。
(5)为防止生成的NaClO2固体被继续还原为NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是_(填字母)
A.过氧化钠 B.硫化钠 C.氯化亚铁 D.高锰酸钾
(6)若mg NaClO3(s)最终制得纯净的n g NaClO2(s),则NaClO2的产率是_×100%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②![]() ③
③![]() ④
④![]() ⑤CH≡C- CH3 ⑥聚乙烯
⑤CH≡C- CH3 ⑥聚乙烯
A.①②③④B.③④⑤C.①②⑤D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G之间的转化关系:
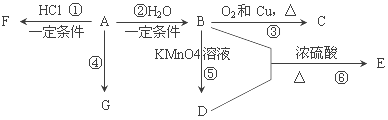
请回答下列问题:
(1)A的官能团的名称是_________;C的结构简式是_____;
(2)B是一种具有特殊香味的液体,由A→B的反应方程式为_____,该反应类型是_____;
(3)G 是一种高分子化合物,其结构简式是_____;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27°C)进行应急处理。写出由A制F的化学反应方程式_____。
(5)D的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zu1emaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
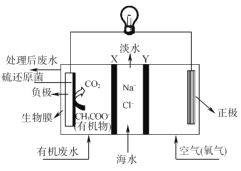
A.该装置可以在高温下工作
B.正极附近溶液的pH值减小
C.负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D.该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
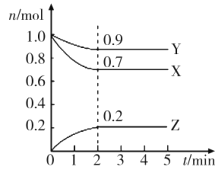
根据图中数据填空:
(1)该反应的化学方程式为___。
(2)若X、Y、Z均为气体,2min时反应达到平衡,此时体系内压强与开始时的压强之比为___。
(3)若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___ (填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TPE(四苯基乙烯)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如下图,下列关于TPE的说法正确的是( )
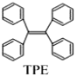
A.TPE的分子式为C26H22
B.TPE能发生加成反应,氧化反应,不能发生取代反应
C.TPE与化合物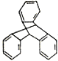 互为同分异构体
互为同分异构体
D.TPE的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
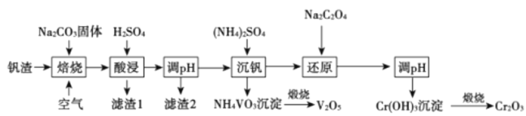
回答下列问题:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________和_______。
(2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______,NH4VO3煅烧过程中的化学方程式是______。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com