
【题目】二甲醚是一种绿色、可再生的新能源。如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法正确的是( )

A. a电极为该电池正极
B. O2在b电极上得电子,被氧化
C. 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O===2CO2↑+12H+
D. 电池工作时,燃料电池内部H+从b电极移向a电极
科目:高中化学 来源: 题型:
【题目】酸碱质子理论认为:凡能给出质子的分子或离子都是酸,凡能结合质子的分子或离子都是碱。按照这个理论,下列属于两性物质的微粒是( )
①H2O ②CN- ③HS- ④CH3COOH ⑤H2PO![]() ⑥OH-
⑥OH-
A.①②⑤B.③④⑥C.①③⑤D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示:
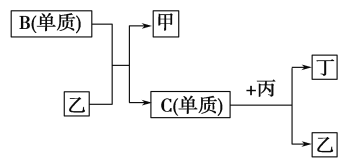
(1)写出B+乙→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号)
①A②B③C④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应
②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______周期第_______族;写出C+丙→乙+丁的化学反应方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 1 L 1 mol/L 的 CH3COOH 溶液中 CH3COO-为 NA个
B. 标况下 22.4 L NO 和 11.2 L O2 反应后,气体分子总数为 NA个
C. 1 L 0.1 mol/L 的 Na2SO3 溶液中离子总数大于 0.3NA
D. H2和 O2反应生成 NA个 H2O(l)和 NA个 H2O(g)放出热量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.常温下,0.1 mol·L-1CH3COONa溶液的pH=8,则该溶液中 c(CH3COOH)=(10-6-10-8)mol·L—1
B.对于相同浓度的弱酸HX和HY(前者的Ka较大)溶液,加水稀释相同倍数时,HY溶液的pH改变值大于HX溶液的pH改变值
C.硫酸钡固体在水中存在以下平衡BaSO4(s)![]() Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
Ba2+(aq)+SO42-(aq),当加入饱和碳酸钠溶液时可以生成BaCO3沉淀
D.常温下,a mol·L-1的CH3COOH溶液与0.01mol·L-1NaOH溶液等体积混合后溶液呈中性,此温度下醋酸的电离平衡常数Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式,下表列举了不同温度下大气固氮和工业固氮的部分K值:
N2+O2 | N2+3H2 | |||
温度 | 25℃ | 2000℃ | 25℃ | 400℃ |
K | 3.84×10-31 | 0.1 | 5×108 | 1.88×104 |
下列说法正确的是
A.在常温下,工业固氮非常容易进行
B.人类可以通过大规模模拟大气固氮利用氮资源
C.大气固氮与工业固氮的K值受温度和压强等的影响较大
D.大气固氮是吸热反应,工业固氮是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备。反应的化学方程式如下:![]() +CH3COOH
+CH3COOH![]()
![]() +H2O
+H2O
某实验小组分别采用以下两种方案合成乙酰苯胺:
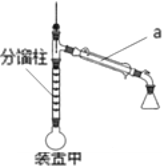
方案甲:采用装置甲:在圆底烧瓶中加入5.0mL苯胺、7.4mL乙酸,加热至沸,控制温度计读数100~105℃,保持液体平缓流出,反应40 min后停止加热即可制得产品。
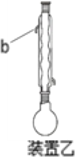
方案乙:采用装置乙:加热回流,反应40 min后停止加热。其余与方案甲相同。
已知:有关化合物的物理性质见下表:
化合物 | 密度(g·cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
乙酸 | 1.05 | 易溶于水,乙醇 | 17 | 118 |
苯胺 | 1.02 | 微溶于水,易溶于乙醇 | –6 | 184 |
乙酰苯胺 | — | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
请回答:
(1)仪器a的名称是_________
(2)分别从装置甲和乙的圆底烧瓶中获得粗产品的后续操作是____________
(3)装置甲中分馏柱的作用是______________
(4)下列说法正确的是__________
A.从投料量分析,为提高乙酰苯胺产率,甲乙两种方案均采取的措施是乙酸过量
B.实验结果是方案甲的产率比方案乙的产率高
C.装置乙中b处水流方向是出水口
D.装置甲中控制温度计读数在118℃以上,反应效果会更好
(5)甲乙两方案获得的粗产品均采用重结晶方法提纯。操作如下:
①请选择合适的编号,按正确的操作顺序完成实验(步骤可重复或不使用)
____→____→____→____→过滤→洗涤→干燥
a冷却结晶 b加冷水溶解 c趁热过滤 d活性炭脱色 e加热水溶解
上述步骤中为达到趁热过滤的目的,可采取的合理做法是___________
②趁热过滤后,滤液冷却结晶。一般情况下,有利于得到较大的晶体的因素有_____
A.缓慢冷却溶液 B.溶液浓度较高
C.溶质溶解度较小 D.缓慢蒸发溶剂
③关于提纯过程中的洗涤,下列洗涤剂中最合适的是_____________。
A.蒸馏水 B.乙醇 C.5%Na2CO3溶液 D.饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com