
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
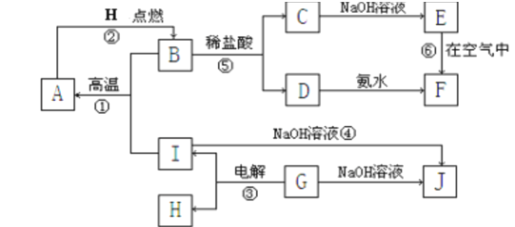
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的叙述中不正确的是( )
A.晶体硅的结构与金刚石的结构类似
B.晶体硅其熔点高、硬度大、不溶于水
C.硅是灰黑色、具有金属光泽的固体
D.硅广泛存在于自然界中,天然单质硅叫硅石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
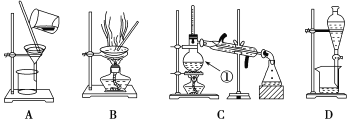
(1) 装置C中①的名称是____________,冷却水的方向是____________。
(2) 从氯化钠溶液中得到氯化钠固体,选择装置______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________,检验自来水中Cl-是否除净的方法为:取少量锥形瓶中的水于洁净试管中,滴加_________溶液,不产生白色沉淀表明Cl-已除净。
Ⅱ.从某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答:
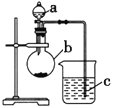
(1) 仪器a的名称是__________,应盛放下列药品中的__________(填字母);
A.稀硫酸 B.亚硫酸 C.氢硫酸 D.盐酸
(2) 仪器b的名称是__________,应盛放下列药品中的__________(填字母);
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3) 仪器c中应盛放的药品是__________,如果看到的现象是__________,证明b中反应产生了__________,即可证明_______比_________酸性强,得电子能力________比________强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
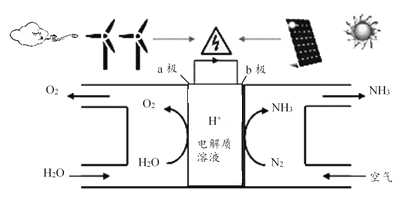
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
C. 基态Fe原子的外围电子排布图为![]()
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
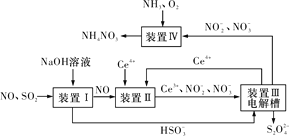
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:____。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为___。
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、环境保护密切相关.下列说法中不正确的是( )
A.加热能杀死流感病毒是因为病毒的蛋白质受热变性
B.人造纤维、合成纤维和光导纤维都是有机高分子化合物
C.方便面的制作过程中常用到纯碱,葡萄酒中一般加入少量SO2作为添加剂
D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com