
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:
NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是____mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx―→N2+CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数之比为____。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
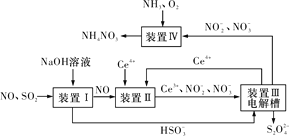
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:____。
(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的____(填“阳极”或“阴极”),同时在另一极生成S2O42-的电极反应式为___。
(5)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
【答案】14∶3 3∶12NO+3H2O+4Ce4+===NO3-+NO2-+6H++4Ce3+阳极2H++2HSO3-+2e-===S2O42-+2H2O243a
【解析】
(1)①根据反应NO+O3=NO2+O2可知NO中氮元素由+2价升高到+4价,生成1molO2时,转移2mole-,标准状况下11.2 L O2的物质的量为0.5mol,所以转移电子的物质的量为1mol;
②反应Ⅱ中,氮元素最终转变为N2,N2既是氧化产物又是还原产物。NO2中氮元素由+4价降低到0价,被还原,CO(NH2)2中氮元素由-3价升高到0价,被氧化,当n(NO2)∶n[CO(NH2)2]=3∶2时,根据元素守恒可知氧化产物与还原产物的物质的量之比为2×2:3=4:3,即为质量之比为4∶3;
(2)CO+NOx―→N2+CO2(未配平),若x=1.5,NOx中氮元素由+3价降低到0价,CO中碳元素由+2价升高到+4价,根据化合价升降守恒可知CO和NOx的化学计量数之比为3:2,结合元素守恒可知CO+NOx―→N2+CO2中CO2和N2的化学计量数比为3:1;
(3)NO被Ce4+氧化生成等物质的量的NO3-和NO2-,根据流程图可知Ce4+被还原为Ce3+,因此离子方程式为2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;
(4)Ce3+失电子被氧化生成Ce4+,电解槽中阳极失电子,因此生成的Ce4+在电解槽的阳极;根据流程图可知HSO3-参与反应,在阴极得电子,因此反应式为2H++2HSO3-+2e-=S2O42-+2H2O;
(5)溶液中的NO2-完全转化为NH4NO3,根据流程图可知装置Ⅳ中加入了氨气和氧气,因此NO2-被氧气氧化生成NO3-,氮元素化合价由+3价升高到+5价,氧气中氧元素由0价降低到-2价,根据化合价升降守恒可知2NO2-~O2,2NO2-的物质的量浓度为a/46mol/L,1 m3中NO2-的物质的量为a/46×103mol,则消耗氧气的物质的量为a/46×103mol÷2=a/92×103mol,标况下体积为V=n×Vm=a/92×103mol×22.4L/mol≈243aL。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现____能转变为____能。水分解时,断裂的化学键为____键,(填极性共价,非极性共价或离子)分解海水的反应属于_____反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的____极;电子从该极_____(填“流入”或“流出”)。电流从该电极_____(填“流入”或“流出”)
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是____,正极上发生反应的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在抗震救灾中要用大量漂白粉和漂白液杀菌消毒。下列说法正确的是
A.漂白粉的有效成分是Ca(ClO)2
B.漂白粉是纯净物,漂白液是混合物
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成份是Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙酸性质的叙述错误的是
A. 乙酸是有强烈刺激性气味的无色液体,易溶于水和乙醇
B. 冰醋酸是纯净物
C. 乙酸的酸性比碳酸强,它是一元酸,能与碳酸盐反应
D. 发生酯化反应时,乙酸羧基中的氢原子跟醇中的羟基结合成水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是 ( )
A.分离水和CCl4的混合物,必须用蒸馏法
B.从Na2CO3溶液中得到Na2CO3,可用过滤法
C.分离NaCl和AgCl的混合物,可用萃取法
D.从I2的CCl4溶液中得到CCl4,可用蒸馏法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与金属钠反应产生H2的速率排序正确的是 ①C2H5OH ②H2O ③CH3COOH
A. ①>②>③ B. ②>①>③ C. ③>②>① D. ③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,浓硫酸既表现出强氧化性又表现出酸性的是( )
A. 2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
B. Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
C. C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
D. 2FeO+4H2SO4(浓)![]() Fe2(SO4)3+SO2↑+4H2O
Fe2(SO4)3+SO2↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com