
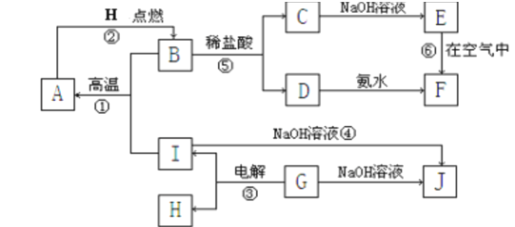
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________。
【答案】FeAl2O32FeCl2+Cl2=2FeCl34Fe﹙OH﹚2+O2+2H2O=4Fe﹙OH﹚32Al+2NaOH+2H2O=2NaAlO2+3H2↑
【解析】
G为地壳中含量最多的金属元素的固态氧化物,G是氧化铝;电解氧化铝生成铝和氧气,氧化铝与氢氧化钠溶液反应生成偏铝酸钠,J是偏铝酸钠;I与氢氧化钠溶液反应生成偏铝酸钠,则I是铝、H是氧气;F是红褐色难溶于水的沉淀,则F是氢氧化铁,根据铁的化合物的知识,E是氢氧化亚铁,A、B、C、D、E、F六种物质中均含铁元素,所以A是Fe,铁在氧气中燃烧生成B,B是四氧化三铁;四氧化三铁与盐酸反应生成C和D,则C是氯化亚铁,D是氯化铁。
G为地壳中含量最多的金属元素的固态氧化物,G是氧化铝;电解氧化铝生成铝和氧气,氧化铝与氢氧化钠溶液反应生成偏铝酸钠,J是偏铝酸钠;I与氢氧化钠溶液反应生成偏铝酸钠,则I是铝、H是氧气;F是红褐色难溶于水的沉淀,则F是氢氧化铁,根据铁的化合物的知识,E是氢氧化亚铁,A、B、C、D、E、F六种物质中均含铁元素,所以A是Fe,铁在氧气中燃烧生成B,B是四氧化三铁;四氧化三铁与盐酸反应生成C和D,则C是氯化亚铁,D是氯化铁。根据以上分析(1)物质的化学式A是Fe;G是Al2O3;(2)氯化亚铁与氯气发生化合反应生成氯化铁,反应化学方程式为2FeCl2+Cl2=2FeCl3;(3)氢氧化亚铁被氧气氧化为氢氧化铁,化学方程式是4Fe﹙OH﹚2+O2+2H2O=4Fe﹙OH﹚3 ;
(4)反应④是铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑。


科目:高中化学 来源: 题型:
【题目】在①蛋白质 ②维生素C ③葡萄糖 ④纤维素四种物质中
(1)不能水解的糖类是_________(填序号,下同);
(2)能水解生成氨基酸的是_________;
(3)在人体中不能直接被消化吸收的是_________;
(4)广泛存在于新鲜蔬菜和水果中,称为抗坏血性酸的是_________,其结构简式为, 则分子式为_________。
则分子式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中可以大量共存的是( )
A.K+、Na+、HCO3-、OH-B.Fe2+、NO3-、Cl-、Na+
C.Al3+、Mg2+、NO3-、OH-D.H+、K+、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮家族化合物繁多,某校研究性学习小组对其进行研究。
研究1:选用下图装置组装制备纯净干燥的NH3并探究NH3与CuO发生的反应,同时检验和收集非固态产物(提示:每个装置只使用一次)。请回答下列问题:
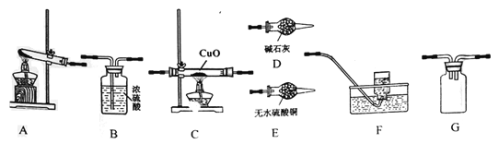
(1)完成实验所需装置按气流方向从左到右的连接顺序为A-(______)-(______)-(______)-G-B-(______)
(2)装置A中发生反应的化学方程式为_________。
(3)D中盛放碱石灰的仪器名称是________,E装置的作用是______。
(4)通过进一步检测发现F中收集到的气体是一种常见的单质气体,硬质玻璃管中得到一种固体单质。试描述该小组同学还能观察到的其它现象为:①C中_____;②E中___;C中反应的化学方程式为:_______
研究2:将32g铜与150mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
(5)在标况下,NO的体积为______L,NO2的体积为______L。
(6)若将产生的气体全部释放后,向溶液中加入VmLa mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为____mol/L。(用含a和V的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
A. N5+共有34个核外电子B. N5+中氮原子以共用电子对结合
C. 化合物N5AsF6中As化合价为+1D. 化合物N5AsF6中F化合价为![]() 1
1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)+3价Co的配合物CoClm·nNH3,中心原子的配位数为6,若1 mol该配合物与足量AgNO3溶液反应生成1 mol AgCl沉淀,用配合物形式写出该配合物的化学式 。
(2)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大磁记录性能越好。离子型氧化物MnO2和Fe3O4及Cr2O3中,磁性最大的是___________。
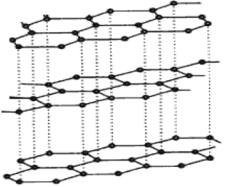
(3)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨(如下左图),每个碳原子通过 杂化与周围碳原子成键。
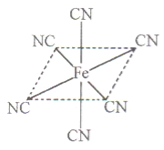
(4)铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如上右图。
①已知CN—与N2结构相似,1molCN-中![]() 键数目为 。
键数目为 。
②上述沉淀溶解过程的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源之一,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)海水分解生成的氢气用于燃料电池时,实现____能转变为____能。水分解时,断裂的化学键为____键,(填极性共价,非极性共价或离子)分解海水的反应属于_____反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-===2H2O;B极:O2+4e-===2O2-,则A极是电池的____极;电子从该极_____(填“流入”或“流出”)。电流从该电极_____(填“流入”或“流出”)
(3)有人以化学反应:2Zn+O2+4H+===2Zn2++2H2O为基础设计出一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作。则原电池的负极材料是____,正极上发生反应的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com