
����Ŀ�������廯���ﷱ�࣬ijУ�о���ѧϰС���������о���
�о�1��ѡ����ͼװ����װ�Ʊ����������NH3��̽��NH3��CuO�����ķ�Ӧ��ͬʱ������ռ��ǹ�̬�����ʾ��ÿ��װ��ֻʹ��һ�Σ�����ش��������⣺
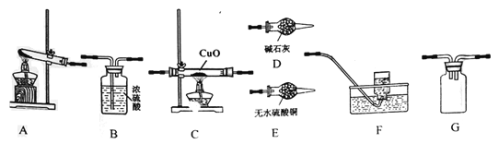
(1)���ʵ������װ�ð�������������ҵ�����˳��ΪA-��______��-��______��-��______��-G-B-��______��
(2)װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ_________��
(3)D��ʢ�ż�ʯ�ҵ�����������________��Eװ�õ�������______��
(4)ͨ����һ����ⷢ��F���ռ�����������һ�ֳ����ĵ������壬Ӳ�ʲ������еõ�һ�ֹ��嵥�ʡ���������С��ͬѧ���ܹ۲쵽����������Ϊ����C��_____����E��___��C�з�Ӧ�Ļ�ѧ����ʽΪ��_______
�о�2����32gͭ��150mLһ��Ũ�ȵ����ᷴӦ��ͭ��ȫ�ܽ⣬������NO��NO2��������ڱ�״���µ����Ϊ11.2L����ش�
(5)�ڱ���£�NO�����Ϊ______L��NO2�����Ϊ______L��
(6)��������������ȫ���ͷź�����Һ�м���VmLa mol/L��NaOH��Һ��ǡ��ʹ��Һ�е�Cu2+ȫ��ת��Ϊ��������ԭ������Һ��Ũ��Ϊ____mol/L�����ú�a��V��ʽ�ӱ�ʾ��
���𰸡�D C E F 2NH4C1+Ca(OH)2![]() CaCl2+2NH3��+2H2O ���θ���� ����NH3��CuO��Ӧ�IJ������Ƿ���ˮ���� C�к�ɫ������죬�Թܱ�����Һ����� E�а�ɫ�������� 2NH3+3CuO
CaCl2+2NH3��+2H2O ���θ���� ����NH3��CuO��Ӧ�IJ������Ƿ���ˮ���� C�к�ɫ������죬�Թܱ�����Һ����� E�а�ɫ�������� 2NH3+3CuO![]() 3Cu+3H2O+N2 5.6 5.6
3Cu+3H2O+N2 5.6 5.6 ![]() (����������Ҳ��)
(����������Ҳ��)
��������
(1)����Aװ���Ʊ�NH3����װ��D���ﰱ�����ٽ�����İ���ͨ��Cװ�ã�����ȵ�CuO��Ӧ��������ˮ����ͭ�����Ƿ���ˮ���ɣ�����Fװ���ռ���Ӧ���ɵ����壬�ݴ˷�������װ�ã�
(2)ʵ�������Ȼ�狀���ʯ�ҷ�Ӧ�Ʊ�������
(3)���������Ľṹ������ȷ������D�����ƣ���ˮ����ͭ��ˮ��������ɫ��
(4)����F���ռ�����������һ�ֳ����ĵ������壬Ӳ�ʲ������еõ�һ�ֺ�ɫ���嵥�ʣ���ϻ�ѧ��Ӧ�ı��ʣ���Ӧǰ��Ԫ�ز������ı䣬��֪������Ϊͭ��������ˮ���Դ���д��ѧ����ʽ��
(5)���ݷ�Ӧ�����е���ת����Ŀ��ȣ����ԭ����Ŀ��ȣ��ɼ����NO��NO2�������
(6)����NԪ���غ㣬���Cuʧȥ���ӵ����ʵ����뷴Ӧ�õ���Cu2+��ϵ�OH-���ʵ�����ȣ�������ʵ���Ũ�ȶ���ʽ���㡣
(1)��Aװ���Ʊ���NH3ͨ��D��ʢװ�ļ�ʯ�Ҹ��������ͨͨ�����ȵ�CuO��Ӧ��Ӧ����E����ˮ����ͭ����ˮ�IJ�����������Gװ�÷�ֹ��������ķ�����������B�е�Ũ��������δ��Ӧ�İ������������Fװ���ռ���Ӧ���ɵ����壬ͬʱҲ���ð�������������ˮ��δ��Ӧ�İ�����ˮ���գ���װ������˳��ΪADCEGBF��
(2)��ʵ�������Ȼ�狀���ʯ�ҷ�Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ2NH4C1+Ca(OH)2![]() CaCl2+2NH3��+2H2O��
CaCl2+2NH3��+2H2O��
(3)D��ʢ�ż�ʯ�ҵ��������������θ���ܣ�װ��E����ˮ����ͭ��ˮ��������ɫ����ɼ���NH3��CuO��Ӧ�IJ������Ƿ���ˮ���ɣ�
(4)C�к�ɫ�Ĺ���CuO��Ϊ��ɫ���嵥�����ʣ��ú�ɫ���嵥����Cu����ˮCuSO4����ɫ��˵����Ӧ������ˮ��ͬʱ����һ������Ⱦ�����壬���˵������ͭ��������ˮ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��2NH3+3CuO![]() 3Cu+3H2O+N2��
3Cu+3H2O+N2��
(5)n(Cu)=32g��64g/mol=0.5mol�����跴Ӧ������NO��NO2�����ʵ���Ϊx��y������ݵ����غ�ɵ�2��0.5mol=3x+y������Nԭ���غ�ɵ�x+y=11.2L��22.4L/mol�����x=0.25mol��y=0.25mol������V(NO)=0.25mol��22.4L/mol=5.6L��V(NO2)=0.25mol��22.4L/mol=5.6L��
(6)HNO3�ڷ�Ӧ�е����ã�һ���ֱ�ΪCu(NO3)2������γ������Σ���һ���ֱ�ΪNO��NO2��n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)�������NaOH�����ʵ�����������ͭ����������ӵ����ʵ���������n(HNO3)=aV��10-3mol+0.5mol���������ʵ���Ũ�ȶ���ʽ�ɵ�c(HNO3)=![]() mol/L��
mol/L��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol/L������Һ��ˮϡ�ͣ�����˵����ȷ����
A. ��Һ��c(OH+)��c(OH-)����СB. ��Һ��c(OH+)����
C. �������ƽ�������ƶ�D. ��Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.2 molij��A�������г��ȼ�պ����ɻ�����B��C��1.2 mol���Իش�
(1)��A�ķ���ʽΪ________��
(2)��ȡһ��������A��ȫȼ�պ�����B��C��3 mol������________g��A�μ��˷�Ӧ��ȼ��ʱ���ı�״���µ�����________L��
(3)����A����ʹ��ˮ��ɫ������һ�������£�������������ȡ����Ӧ����һ�ȴ���ֻ��һ�֣�����A�Ľṹ��ʽΪ________________________________��
(4)����A��ʹ��ˮ��ɫ���ڴ��������£���H2�ӳɣ���ӳɲ��ᆳ�ⶨ�����к���4��������A�����еĽṹ��ʽΪ____________________________________������A��2��̼ԭ�ӵ�ͬϵ����________��ͬ���칹�塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯������ͨ��һ����Ӧֱ����ɵ���
A. Al(OH)3 �� Al2O3 B. Al2O3 �� Al(OH)3
C. Al �� AlO2- D. Al3+ �� Al(OH)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��Ĵ����������磬�Ʊ��մ��������[��Ҫ�ɷ�Al2Si2O5(OH)4]Ϊԭ�ϣ��������ս���ɡ�������������ʽ��ʾ�������ɣ�ӦдΪ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��I�ֱ��ʾ��ѧ��ѧ�г�����һ�����ʣ�����֮�����ϵ����ͼ��ʾ�����ַ�Ӧ�������û���г���������֪GΪ�ؿ��к������Ľ���Ԫ�صĹ�̬�����F�Ǻ��ɫ������ˮ�ij�����A��B��C��D��E��F���������о���ͬһ��Ԫ�ء�
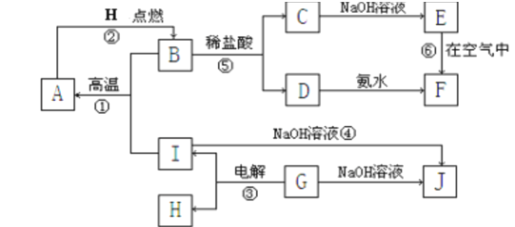
����д���пհף�
��1��д���������ʵĻ�ѧʽA_______________��G____________________��
��2����C��DΪ���Ϸ�Ӧ�����ʱ�Ļ�ѧ����ʽ_______________________________��
��3��д��E��F�Ļ�ѧ����ʽ___________________________________________ ��
��4��д����Ӧ�ܵ����ӷ���ʽ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ձ���ʢ��Ũ���ᣬ���ձ��ڷ�����ͭ�����ӵ�����Ǧ�����缫����֪��ԭ���ֹͣ����ʱ��Fe��Pb����ʣ�ࡣ����˵����ȷ���ǣ� ��
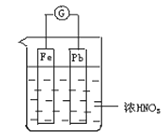
A. Fe��Pb���ã�ʼ��������
B. Fe��Ũ�����жۻ�ʼ�ղ��ܽ⡣
C. ���ֹͣ����ʱ����Fe(NO3)3����
D. ����Ũ���������Һ�����ϡ���ɫ��ѧ����˼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������20 mL 0.1 mol/L HA��Һ����μ���0.1 mol/L NaOH��Һ����pH�仯������ͼ��ʾ(�����¶ȱ仯)������˵���в���ȷ����

A. �����֪HAΪ����
B. �ζ��յ�λ��c��d֮��
C. �ζ���b��ʱ��n(Na+)+ n(H+)��n(OH��)+ n(HA)=0.002 mol
D. �ζ���d��ʱ��c(OH��)��c(Na+)��c(A��) ��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
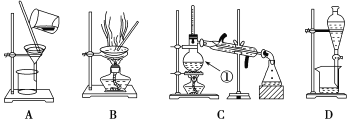
(1) װ��C�Тٵ�������____________����ȴˮ�ķ�����____________��
(2) ���Ȼ�����Һ�еõ��Ȼ��ƹ��壬ѡ��װ��______(�����װ��ͼ����ĸ����ͬ)����ȥ����ˮ�е�Cl�������ʣ�ѡ��װ��________����������ˮ��Cl���Ƿ�����ķ���Ϊ��ȡ������ƿ�е�ˮ�ڽྻ�Թ��У��μ�_________��Һ����������ɫ��������Cl���ѳ�����
��.��ijͬѧ��ͨ��ʵ��̽�����̼�õ���������ǿ����ͨ���Ƚ���������������Ӧˮ���������ǿ������֤���������ͼʵ�飬��ش�
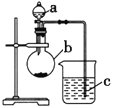
(1) ����a��������__________��Ӧʢ������ҩƷ�е�__________(����ĸ)��
A.ϡ���� B.������ C.������ D.����
(2) ����b��������__________��Ӧʢ������ҩƷ�е�__________(����ĸ)��
A.̼��� B.������ C.�Ȼ��� D.̼����
(3) ����c��Ӧʢ�ŵ�ҩƷ��__________�����������������__________��֤��b�з�Ӧ������__________������֤��_______��_________����ǿ���õ�������________��________ǿ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com