
【题目】有一种含高能量的正离子N5+的化合物N5AsF6,下列叙述错误的是( )
A. N5+共有34个核外电子B. N5+中氮原子以共用电子对结合
C. 化合物N5AsF6中As化合价为+1D. 化合物N5AsF6中F化合价为![]() 1
1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某含锰矿石的主要成分是MnO2,还含CaO、Al2O3、FeS杂质,由此矿石生产MnCO3的工艺流程如图所示:


已知:①相关金属离子生成氢氧化物沉淀的pH如表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.8 | 4.7 |
Mn(OH)2 | 8.8 | 10.4 |
Ca(OH)2 | 12 | ─ |
②常温下,Ksp(CaF2)=3.95×10-11
回答下列问题:
(1)酸溶时,是否能将稀硫酸换成浓盐酸______(填“是”或“否”);操作I的名称为______________。
(2)取溶液Ⅰ加入KSCN溶液,溶液呈血红色,试写出酸溶过程中MnO2与FeS发生反应的离子方程式:______。
(3)调节溶液Ⅰ的pH时,pH的范围为_________;所用的物质X最好是________(填字母)。
A.盐酸 B.NaOH溶液 C.氨水 D.MnCO3固体
(4)滤渣Ⅰ为___________________,滤渣Ⅱ为_____________。(填化学式)
(5)沉锰的化学方程式为_________________________________________。
(6)沉锰后过滤得到固体MnCO3,设计实验方案验证MnCO3固体是否洗涤干净:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四个起始容积相同的密闭容器中充入表中所示气体及相应的量,加入催化剂并控制温度、容积或压强,发生反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g) ![]() H<0,直至达平衡。下列说法错误的是
H<0,直至达平衡。下列说法错误的是
编号 | 条件 | 起始物质的量/mol | ||||
温度/℃ | 容积或压强 | CO(g) | NO (g) | CO2 (g) | N2 (g) | |
① | 600 | 维持恒容 | 0.2 | 0.2 | 0 | 0 |
② | 700 | 维持恒容 | 0.1 | 0.1 | 0.1 | 0.05 |
③ | 600 | 维持恒容 | 0.4 | 0.4 | 0 | 0 |
④ | 600 | 维持恒压 | 0.4 | 0.4 | 0 | 0 |
A. 平衡时N2的浓度:①>②
B. 平衡时CO的正反应速率:①<②
C. NO的平衡转化率:③>①
D. 平衡时容器内气体总压:④>③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻,如图,则下列说法正确的是( )

A. 两烧杯中均无气泡产生 B. 左边烧杯中的溶液质量减少了
C. 去掉两烧杯,杠杆仍平衡 D. 右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为地壳中含量最多的金属元素的固态氧化物,F是红褐色难溶于水的沉淀,A、B、C、D、E、F六种物质中均含同一种元素。
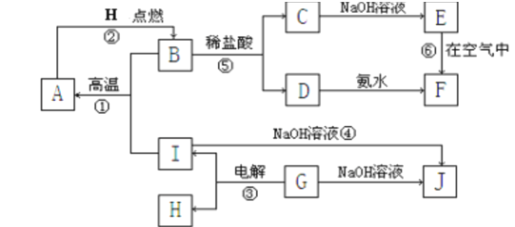
请填写下列空白:
(1)写出下列物质的化学式A_______________;G____________________;
(2)若C→D为化合反应,则此时的化学方程式_______________________________;
(3)写出E→F的化学方程式___________________________________________ ;
(4)写出反应④的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:
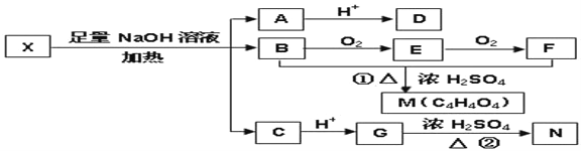
已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
4NO(g)+6H2O(g) ΔH=-a kJ·mol-1 在5 L密闭容器中进行,10 s时,水蒸气的物质的量增加了0.60 mol。则下列说法不正确的是( )
A. 10 s内,NH3的平均反应速率为0.008 mol·L-1·s-1
B. 该反应达到平衡时6v正(O2)=5v逆(H2O)
C. 10 s内,反应放出的热量为0.1a kJ
D. 10 s时,H2O的反应速率为0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为迎接G20峰会的到来,浙江加大了对环境治理的力度。其中对含氮化物的处理是一个重要的课题。
Ⅰ.氮氧化物
(1)已知:N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如下

①2NO(g) ![]() N2(g)+O2(g) △H=_______________
N2(g)+O2(g) △H=_______________
②你认为该反应能否自发,并说明理由____________________________________
(2)科学家利用2NO(g) ![]() N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________
N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________

Ⅱ.亚硝酸盐
(1)来源:用氧化性熔融盐处理钢铁表面氧化膜时会产生污染物亚硝酸盐,请写出FeO与NaNO3在加热条件下发生的反应________________________。
(2)电化学处理:用电解法降解NO2其原理如下图所示电源正极为_______(填A或B),阴极反应式为__________________________________ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
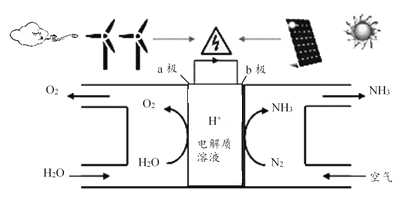
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com