
【题目】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
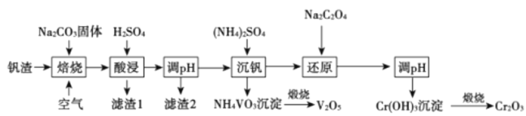
回答下列问题:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________和_______。
(2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______,NH4VO3煅烧过程中的化学方程式是______。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______(保留两位有效数字)。
【答案】Na2SiO3 NaAlO2 H2SiO3 4.7 NH4++VO3-=NH4VO3↓ 2NH4VO3![]() V2O5+2NH3↑+H2O↑ 3C2O42-+2CrO42-+16H+= 2Cr3++6CO2↑+8H2O c(Na+)>c(HC2O4-)>c(H+)>C2O42->c(OH-) 0.38
V2O5+2NH3↑+H2O↑ 3C2O42-+2CrO42-+16H+= 2Cr3++6CO2↑+8H2O c(Na+)>c(HC2O4-)>c(H+)>C2O42->c(OH-) 0.38
【解析】
“焙烧”时,Fe2O3、Fe3O4不和Na2CO3、O2反应,V2O5、Cr2O3和Na2CO3、O2反应转化为NaVO3、Na2CrO4,SiO2、Al2O3和Na2CO3反应转化成Na2SiO3、NaAlO2;
“酸浸”时,Na2SiO3和硫酸反应生成H2SiO3沉淀,滤渣1主要成分是硅酸,同时AlO2-转化成Al3+,铁的两种氧化物溶于酸得到Fe2+和Fe3+;
“调pH”时,将铝元素、铁元素转化为Al(OH)3和Fe(OH)3沉淀,滤渣2主要成分为Al(OH)3和Fe(OH)3;
“沉钒”时,NH4+和VO3-形成NH4VO3沉淀,NH4VO3沉淀煅烧得V2O5;
“还原”时,用Na2C2O4将CrO42-还原成Cr3+,调合适的pH将Cr3+转化为Cr(OH)3沉淀,Cr(OH)3沉淀煅烧得到Cr2O3,据以上分析解答。
(1) 高温时,氧化铝和碳酸钠反应生成偏铝酸钠和二氧化碳,二氧化硅和碳酸钠反应生成硅酸钠和二氧化碳,即SiO2、Al2O3转化为Na2SiO3和NaAlO2,故答案为:Na2SiO3;NaAlO2;
(2)由分析可知,滤渣1主要为H2SiO3,Ksp[Fe(OH)3]=4.0×10-38,Fe3+浓度小于1×10-5mol/L时认为沉淀完全,Fe3+浓度为1×10-5mol/L时,c3(OH-)×1×10-5mol/L=4.0×10-38,c3(OH-)=4.0×10-33,c3(H+)=![]() ,c(H+)=
,c(H+)=![]() ×10-4≈6×10-4,pH≈4-lg6<4。Al3+浓度为1×10-5mol/L时,c3(OH-)×1×10-5mol/L=1.0×10-33,c3(OH-)=1.0×10-28,c3(H+)=
×10-4≈6×10-4,pH≈4-lg6<4。Al3+浓度为1×10-5mol/L时,c3(OH-)×1×10-5mol/L=1.0×10-33,c3(OH-)=1.0×10-28,c3(H+)=![]() ,c(H+)=
,c(H+)=![]() ,pH=-lg(
,pH=-lg(![]() )=5- lg(
)=5- lg(![]() )≈4.7>4,综上所述,要使A3+和Fe3+完全沉淀,p不低于4.7,故答案为:H2SiO3;4.7;
)≈4.7>4,综上所述,要使A3+和Fe3+完全沉淀,p不低于4.7,故答案为:H2SiO3;4.7;
(3)“沉钒”时,NH4+和VO3-形成NH4VO3沉淀,离子方程式为:NH4++VO3-=NH4VO3↓,NH4VO3沉淀煅烧得到V2O5,元素化合价没变化,根据原子守恒可知,产物含有H2O和NH3,方程式为:2NH4VO3![]() V2O5+2NH3↑+H2O↑,故答案为:NH4++VO3-=NH4VO3↓;2NH4VO3
V2O5+2NH3↑+H2O↑,故答案为:NH4++VO3-=NH4VO3↓;2NH4VO3![]() V2O5+2NH3↑+H2O↑;
V2O5+2NH3↑+H2O↑;
(4) “还原”时,C2O42-将CrO42-还原成Cr3+,pH在2.5左右,溶液为酸性,C2O42-被氧化为CO2,结合电子得失守恒、原子守恒可得离子方程式为:3C2O42-+2CrO42-+16H+= 2Cr3++6CO2↑+8H2O,故答案为:3C2O42-+2CrO42-+16H+= 2Cr3++6CO2↑+8H2O;
(5) HC2O4-会水解、电离,所以,c(Na+)>c(HC2O4-),HC2O4-的电离常数= Ka2=6. 4×10-5,HC2O4-的水解常数Kh=![]() =
=![]() ≈1.7×10-13,电离常数>>水解常数,加之水电离也能产生一定的H+,所以c(H+)>C2O42->c(OH-)。水解和电离都是微弱的,所以,c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),综上所述:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。H2C2O4
≈1.7×10-13,电离常数>>水解常数,加之水电离也能产生一定的H+,所以c(H+)>C2O42->c(OH-)。水解和电离都是微弱的,所以,c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),综上所述:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)。H2C2O4![]() H++HC2O4-,Ka1=
H++HC2O4-,Ka1=![]() ,HC2O4-
,HC2O4-![]() H++C2O42-,Ka2=
H++C2O42-,Ka2=![]() ,Ka1×Ka2=
,Ka1×Ka2=![]() ×
×![]() =
=![]() 。pH= 2.5,则c(H+)=10-2.5,所以,
。pH= 2.5,则c(H+)=10-2.5,所以,![]() =
=![]() =0.38(保留两位有效数字),即c(C2O42- ):c(H2C2O4)=0.38,故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);0.38;
=0.38(保留两位有效数字),即c(C2O42- ):c(H2C2O4)=0.38,故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);0.38;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】两气体A、B分别为0.6mo1与0.5mo1,在0.4L密闭容器中发生反应:3A+BmC+2D(C、D均为气态物质),经5min后达到平衡,此时C为0.2mo1,在此时间内D的平均反应速率为0.1mo1L-1min-1,下列结论错误的是( )
A.平衡时反应混合物总物质的量为1mo1
B.B的转化率为20%
C.A的平均反应速率为0.15mo1L-1min-1
D.m值为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铵铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
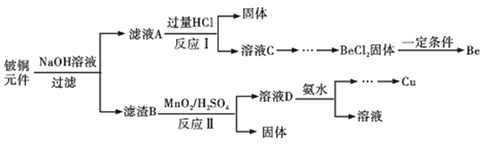
已知:
Ⅰ.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13
(1)滤渣B的主要成分为______(填化学式);
(2)写出反应Ⅰ中含铍化合物与过量盐酸反应的化学方程式______;
(3)MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的离子方程式______,若用浓HNO3溶解金属硫化物缺点是______(任写一条);
(4)从BeCl2溶液中得到BeCl2固体的操作是______。
(5)溶液D中含c(Cu2+)=2.2molL-1、c(Fe3+)=0.008molL-1、c(Mn2+)=0.01molL-1,逐滴加入稀氨水调节pH可依次分离首先沉淀的是______(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于______;
(6)取铍铜元件1000g,最终获得Be的质量为72g,则Be的产率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol铵根离子中含有的电子数为9NA
B.38.5gCCl4中含有的共用电子对数为NA
C.16gO3单质中含有的分子个数为NA
D.通常状况下,11.2 LCl2通入足量的NaOH溶液中,转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。
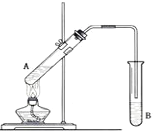
(1)试管B中盛放的溶液是_____________,其作用是:_____________
(2)反应的化学方程式是____________
(3)分离产物用的仪器是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂碳、铝、铬是重要的元素,在工业生产和科技中有重要的应用。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为_____________。
(2)金属锂是锂电池重要的组成部分。Li、Be、B 原子的第一电离能由大到小的顺序为______。
(3)LiAlH4是有机合成中常用的还原剂。AlH4-的空间构型为___________。
(4)![]() +
+
![]()
![]() +CH3COOH
+CH3COOH
①乙酸酐分子中碳原子轨道的杂化类型为________。
②l mol对甲基苯乙酮分子中含有的σ键的数目为_______
③甲苯分子难溶于水的原因是________。
(5)已知铬酸钙晶胞如图所示,该晶体密度为ρ g·cm-1,NA是阿伏加德罗常数的值。Ca离子周围距离最近且相等的O有_____个。相邻两个面心氧离子最短核间距(d)为_______pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() (X)、
(X)、![]() (Y)、
(Y)、![]() (Z)的分子式均为C5H6。下列说法正确的是( )
(Z)的分子式均为C5H6。下列说法正确的是( )
A.X、Y、Z均能使酸性高锰酸钾溶液褪色
B.Z的同分异构体只有X和Y两种
C.Z的二氯代物只有两种(不考虑立体异构)
D.Y分子中所有碳原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__。基态K+的电子排布式为__。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__,中心原子的杂化方式为__。NaBH4中存在__(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为__,其中Be的配位数为__。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:___。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=__g·cm-3(列出计算表达式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程需要不断添加Fe2(SO4)3溶液
B.脱硫过程O2间接氧化H2S
C.亚铁是血红蛋白的重要组成成分,FeSO4可用于治疗缺铁性贫血
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,说明我国古代已利用天然气煮盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com