
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__。基态K+的电子排布式为__。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__,中心原子的杂化方式为__。NaBH4中存在__(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为__,其中Be的配位数为__。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:___。
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=__g·cm-3(列出计算表达式)。

【答案】F>O>B 1s22s22p63s23p6或[Ar] 正四面体 sp3 ac ![]() 3 前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大
3 前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大 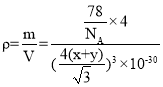
【解析】
(1)氟代硼酸钾中非金属元素有F、O、B,元素的非金属性越强,电负性越大;基态K+核外电子总数为18;
(2)BH4-的中心原子B原子孤电子对数=![]() =0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键;
=0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键;
(3)双聚分子为Be2Cl4,Be原子价电子数为2,形成2个Be-Cl键,Be原子有空轨道、Cl原子有孤电子对,每个BeCl2分子中的1个Cl原子另外分子中Be原子之间形成1个配位键;
(4)氟化物的熔点与晶体类型,离子晶体的熔点较高,分子晶体的熔点较低;离子半径越小、电荷越大,晶格能越大,离子晶体的熔沸点越高。而相对分子质量越大,分子间作用力越强,分子晶体的熔沸点越高;
(5)晶胞中白色球数目为4、黑色球数目为1+8×![]() +6×
+6×![]() +12×
+12×![]() =8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=
=8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=![]() pm,故晶胞棱长=
pm,故晶胞棱长=![]() pm,计算晶胞中微粒总质量,即为晶胞质量,晶体密度=晶胞质量÷晶胞体积。
pm,计算晶胞中微粒总质量,即为晶胞质量,晶体密度=晶胞质量÷晶胞体积。
(1)氟代硼酸钾中非金属元素有F、O、B,非金属性强弱顺序为F>O>B,电负性大小顺序为F>O>B;基态K+核外电子总数为18,则电子排布式为1s22s22p63s23p6或[Ar];
(2)BH4-的中心原子B原子孤电子对数=![]() =0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同为正四面体形,B原子采取sp3杂化;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键,没有氢键与π键,故答案为ac;
=0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同为正四面体形,B原子采取sp3杂化;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键,没有氢键与π键,故答案为ac;
(3)双聚分子为Be2Cl4,Be原子价电子数为2,形成2个Be-Cl键,Be原子有空轨道、Cl原子有孤电子对,每个BeCl2分子中的1个Cl原子另外分子中Be原子之间形成1个配位键,BeCl2的结构式为![]() ,其中Be的配位数为3;
,其中Be的配位数为3;
(4)NaF、MgF2和AlF3为离子晶体,晶格能依次增大,熔点依次升高,而SiF4、
(5)晶胞中白色球数目为4、黑色球数目为1+8×![]() +6×
+6×![]() +12×
+12×![]() =8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据,可知Ca2+占据F-形成的空隙占有率为50%;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=
=8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据,可知Ca2+占据F-形成的空隙占有率为50%;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=![]() pm,故晶胞棱长=
pm,故晶胞棱长=![]() pm,晶胞相当于含有4个“CaF2”,晶胞质量=4×
pm,晶胞相当于含有4个“CaF2”,晶胞质量=4×![]() g,晶体密度
g,晶体密度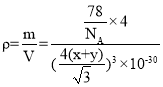 gcm-3。
gcm-3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】TPE(四苯基乙烯)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如下图,下列关于TPE的说法正确的是( )
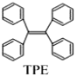
A.TPE的分子式为C26H22
B.TPE能发生加成反应,氧化反应,不能发生取代反应
C.TPE与化合物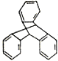 互为同分异构体
互为同分异构体
D.TPE的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
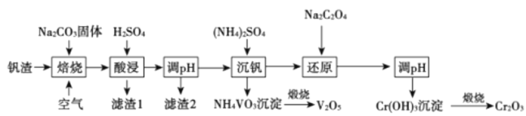
回答下列问题:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________和_______。
(2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______,NH4VO3煅烧过程中的化学方程式是______。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 容器内压强不随时间变化B. 容器内,3种气体AB、A2、B2共存
C. 容器中各组分的体积分数不随时间变化D. AB的消耗速率等于A2的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理为H2SO4(浓)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
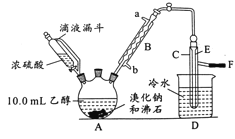
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中进水口为__口(填“a”或“b”)。
(2)实验中用滴液漏斗代替分液漏斗的优点为__。
(3)氢溴酸与浓硫酸混合加热发生氧化还原反应的化学方程式__。
(4)给A加热的目的是__,F接橡皮管导入稀NaOH溶液,其目的是吸收__和溴蒸气,防止__。
(5)C中的导管E的末端须在水面以下,其原因是__。
(6)将C中的镏出液转入锥形并瓶中,连振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,使溶液分层后用分液漏斗分去硫酸层;将经硫酸处理后的溴乙烷转入蒸镏烧瓶,水浴加热蒸馏,收集到35~40℃的馏分约10.0g。
①分液漏斗在使用前必须__;
②从乙醇的角度考虑,本实验所得溴乙烷的产率是__(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料该小组同学通过网络查询得知,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。
① 称取1.260 g纯草酸晶体,将其酸制成100.00 mL水溶液为待测液。
② 取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③ 用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;请回答:
(1)将草酸晶体配制成溶液时,必须用到的玻璃仪器是烧杯、玻璃棒、_____、______。
(2)滴定时,将KMnO4标准液装在右图中的________(填“甲”或“乙”)滴定管中。
![]()
(3)本实验滴定达到终点的标志是________。
(4)通过上述数据,计算出x=________。
(5)下列滴定操作会使测得的x值偏大的是________。
A.滴定终点时俯视滴定管刻度
B. 滴定终点时仰视滴定管刻度
C.滴定时所用的KMnO4溶液因久置而导致浓度变小
D.滴定管尖嘴内在滴定前有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,彼此之间关系正确的是
A. C(金刚石)与C(石墨)属于同位素
B. CH2=CH2和CH2=CH-CH=CH2属于同系物
C. CH3CH(CH3)2和CH4属于同系物
D. ![]() 与
与![]() 是同分异构体
是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
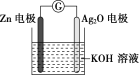
A.Zn电极是负极
B.Zn电极的电极反应式:Zn-2e-+2OH-=Zn(OH)2
C.Ag2O电极发生还原反应
D.放电前后电解质溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.0lmol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgC1)数量级为10-10。下列叙述不正确的是( )
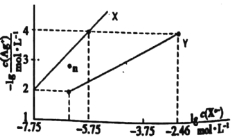
A.图中Y线代表的Ag2C2O4
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgC1沉淀
D.Ag2C2O4+2Cl-=2AgC1+C2O42-的平衡常数为1.0×10-0.7l
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com