
【题目】天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A.该脱硫过程需要不断添加Fe2(SO4)3溶液
B.脱硫过程O2间接氧化H2S
C.亚铁是血红蛋白的重要组成成分,FeSO4可用于治疗缺铁性贫血
D.《华阳国志》记载“取井火煮之,一斛水得五斗盐”,说明我国古代已利用天然气煮盐
【答案】A
【解析】
根据图示过程,Fe2(SO4)3在T.F菌的作用下将硫化氢氧化为硫单质,同时自身还原为硫酸亚铁,硫酸亚铁在氧气的氧化下生成硫酸铁,生成的硫酸铁又继续氧化硫化氢,形成循环,在此过程中硫酸铁可视为催化剂,据此回答。
A.T.F菌在酸性溶液中可实现天然气的催化脱硫,Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,Fe2(SO4)3可视为催化剂,该脱硫过程不需要不断添加Fe2(SO4)3溶液,A错误;
B.脱硫过程:Fe2(SO4)3氧化硫化氢,自身被还原成硫酸亚铁,硫酸亚铁被氧气氧化成硫酸铁,脱硫过程O2间接氧化H2S,B正确;
C.亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,若缺铁就可能出现缺铁性贫血,需补充一定量的亚铁离子,C正确;
D.天然气主要成分为甲烷,甲烷燃烧放出热量,井火为天然气燃烧出现的火焰,故说明我国古代已利用天然气煮盐,D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
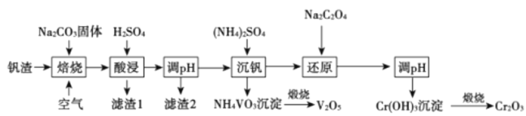
回答下列问题:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________和_______。
(2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______,NH4VO3煅烧过程中的化学方程式是______。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,彼此之间关系正确的是
A. C(金刚石)与C(石墨)属于同位素
B. CH2=CH2和CH2=CH-CH=CH2属于同系物
C. CH3CH(CH3)2和CH4属于同系物
D. ![]() 与
与![]() 是同分异构体
是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
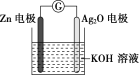
A.Zn电极是负极
B.Zn电极的电极反应式:Zn-2e-+2OH-=Zn(OH)2
C.Ag2O电极发生还原反应
D.放电前后电解质溶液的pH保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种用途广泛的化工原料。金属镓是一种广泛用于电子工业和通讯领域的重要金属,镓元素(31Ga)在元素周期表中位于第四周期IIIA族,化学性质与铝元素相似。
(1)下图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
已知:N2(g)+3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0

①曲线c对应的温度是_____。
②关于工业合成氨的反应,下列叙述正确的是_____(填字母)。
A.及时分离出NH3可以提高H2的平衡转化率
B.根据勒夏特列原理,一般采用高温下发生反应
C.上图中M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N)
③工业上合成氨的催化剂为铁触媒,选择温度为500℃的原因是______。
(2)工业上利用Ga与NH3合成固体半导体材料氮化镓(GaN)同时有氢气生成。反应中,生成3molH2时就会放出30.8kJ的热量。
①该反应的热化学方程式是__________。
②该反应的化学平衡常数表达式是_____。
③在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是_____。
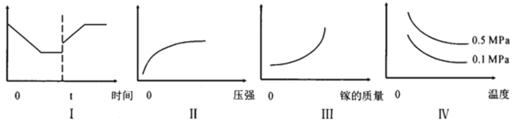
A.I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温
B.II图像中纵坐标可以为镓的转化率
C.III图像中纵坐标可以为化学反应速率
D.Ⅳ图像中纵坐标可以为体系内混合气体平均相对分子质量
④氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中,该反应的离子方程式是________。
(3)将一块镓铝合金完全溶于烧碱溶液中得到溶液X。己知:
Al(OH)3 | Ga(OH)3 | |
酸式电离常数Ka | 2×10-11 | 1×10-7 |
碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
往X溶液中缓缓通入CO2,最先析出的氢氧化物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有
①除去乙烷中混有的乙烯可以将气体通过足量KMnO4溶液;
②超导陶瓷在某一临界温度下电阻为零,可用于电力、交通、医疗等领域;
③煤燃烧时加入适量石灰石,可减少废气中SO2的量;
④可以用加热氯化铵固体,再用碱石灰除去氯化氢的方法制氨气;
⑤高分子材料中的有机物分子均呈链状结构;
⑥除去粗盐溶液中的Ca2+、Mg2+和SO![]() ,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
,可向溶液中依次加入过量BaCl2、NaOH、Na2CO3和HCl溶液,再过滤。
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.0lmol/L的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。已知Ksp(AgC1)数量级为10-10。下列叙述不正确的是( )
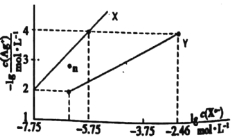
A.图中Y线代表的Ag2C2O4
B.n点表示AgCl的过饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成AgC1沉淀
D.Ag2C2O4+2Cl-=2AgC1+C2O42-的平衡常数为1.0×10-0.7l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用下图所示装置制取纯净的无水![]() 。试回答下列问题:
。试回答下列问题:
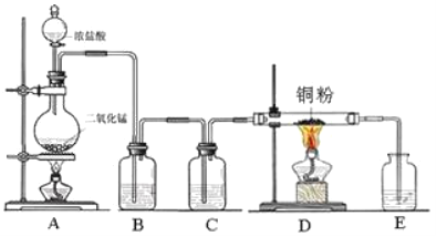
(1)写出烧瓶中发生反应的化学方程式,并用双线桥标出电子转移的方向和数目______________。
(2)B处盛有饱和食盐水的作用是______________。
(3)C处盛放的试剂__________(填名称),其作用是______________。
(4)E处盛有___________(填名称),其作用是______________,发生反应的离子方程式为___________________。
(5)实验开始时,应先点燃__________处(填字母,下同)酒精灯;实验结束时,应先熄灭__________处酒精灯。
(6)D处发生反应的化学方程式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com