
����Ŀ����֪: 25�桢101 kPa�£��� 2 Na(s) + 1/2 O2(g) = Na2O(s) ��H1 = - 414 kJ / mol
�� 2 Na(s) + O2(g) = Na2O2(s) ��H2 = - 511 kJ / mol
����˵����ȷ����
A. ������������������Ӹ����Ȳ����
B. ���������ɵ����ʵ����IJ��ת�Ƶ�������ͬ
C. ������Na������O2��Ӧ����Na2O�����¶���������Na2O�������ӿ�
D. 25�桢101 kPa�£�Na2O2(s) + 2 Na(s) = 2 Na2O(s) ��H = -317 kJ / mol
���𰸡�D
�����������������A�����������������Ӹ�����Ϊ1��2���������Ƶĵ���ʽΪ��![]() ���������Ӹ�����Ϊ1��2���ʴ���B�����ɵ����ʵ����IJ�������ĵ�Na�����ʵ�����ȣ�ת�Ƶ������ʵ�����ȣ��ʴ���C���¶����ߣ��ƺ�������Ӧ���ɹ������ƣ��ʴ���D���١�2����2Na(s)��Na2O2(s)=2Na2O(s) ��H=(��414��2��511)kJ��mol��1=��317kJ��mol��1������ȷ��
���������Ӹ�����Ϊ1��2���ʴ���B�����ɵ����ʵ����IJ�������ĵ�Na�����ʵ�����ȣ�ת�Ƶ������ʵ�����ȣ��ʴ���C���¶����ߣ��ƺ�������Ӧ���ɹ������ƣ��ʴ���D���١�2����2Na(s)��Na2O2(s)=2Na2O(s) ��H=(��414��2��511)kJ��mol��1=��317kJ��mol��1������ȷ��


 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ô���ʯ�������Ʊ�CO2 �� ���д�ʩ��ʹ��Ӧ���ʼӿ���ǣ� ��
A.���ͷ�Ӧ�¶�
B.�ӳ���Ӧʱ��
C.�������ʯ
D.��ˮϡ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B�����������ǵ������ͬ����Լ��85.7%��̼����A������������ܶ���28����B��ʽ������A��һ�룬��A��B����ʹ������Ȼ�̼��Һ��ɫ����������ʵ����ʵ�ش����⡣
��1���ƶ�A��B�����ķ���ʽ��A ��B ��
��2��A��B��(�A����B��)����ͬ���칹�壬ͬ���칹��������� �� �� �� ��(�ж���д����)
��3��д��B��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ��������ǣ� ��
A. ������ B. ������ C. ������ D. ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鲻�ܴﵽʵ��Ŀ�Ļ���ʵ���������ȷ����
A. ����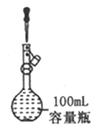
B. �Ƚ���̼��������Ԫ��
C. �����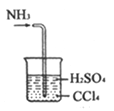
D. �ⶨ��ͭ(Cu��Zn�صķǽ�����ǿ���Ͻ���Zn�ĺ���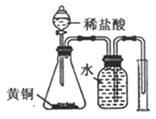
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ���й�����ˮ��������ȷ���� �� ��
A��������ˮ��ֻ��Cl2��H2O����
B��������ˮ����ʹ�������ɫ������ɫ
C��������ˮ�������ݳ�����������Cl2
D��������ˮ��ʹ��ɫʯ����ֽ�ȱ�����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڼ������±�ص�˵����,��������( )��
A.���ź˵����������,�����Ԫ�غ�±�ص�ԭ�Ӱ뾶��������
B.�����Ԫ����,�ԭ��ʧȥ���ӵ���������,±����,��ԭ�ӵõ���������ǿ
C.����ˮ�ķ�Ӧ������ˮ�ķ�Ӧ������
D.�嵥����ˮ��Ӧ���ȵ�����ˮ��Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����x molʯӢ�����У�����Si��O������
A. x mol B. 2x mol C. 3x mol D. 4x mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���⡢��3��Ԫ����ɵ��л���A����Է�������Ϊ102���������������Ϊ9.8%����������ԭ�Ӹ���Ϊ����5����һ�������£�A��������Ӧ����B��B���ӵĽṹ����Ϊ1��̼ԭ��������2����������2���ṹ��ͬ�Ļ��š���B�ĺ˴Ź���������ʾ��3�鲻ͬ�ķ塣
��1��A�ķ���ʽ�� ��
��2������������A�����������ϣ��������ʵ���һ�������ȼ�����������������������ˮ����Ҳ��ȵ��ǣ�����ţ� ��
A��C5H12O3 B��C4H10 C��C6H10O4 D��C5H10O
��3����B�Ľṹ��ʽ�� ����A���������ķ�Ӧ�ǣ�����ţ� ��
A��ȡ����Ӧ B����ȥ��Ӧ C��������Ӧ D����ԭ��Ӧ
��4��A������һ������ͬ���칹�壬���칹��������������ˮ�⣬����������Է���������ͬ�Ļ��������һ�ֵķ�������2�����������칹��Ľṹ��ʽ�ǣ� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com