
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol铵根离子中含有的电子数为9NA
B.38.5gCCl4中含有的共用电子对数为NA
C.16gO3单质中含有的分子个数为NA
D.通常状况下,11.2 LCl2通入足量的NaOH溶液中,转移的电子数为0.5NA
【答案】B
【解析】
A.铵根离子是10电子微粒,则1 mol铵根离子中含有10mol电子,电子数为10NA个,故A错误;
B.38.5 g CCl4的物质的量为![]() =0.25mol,1个CCl4中含有4个C-Cl键,即4对共用电子对,所以0.25molCCl4中含有1mol共用电子对,数目为NA,故B正确;
=0.25mol,1个CCl4中含有4个C-Cl键,即4对共用电子对,所以0.25molCCl4中含有1mol共用电子对,数目为NA,故B正确;
C.16g O3单质的物质的量为![]() =
=![]() mol,含有的分子个数为
mol,含有的分子个数为![]() NA,故C错误;
NA,故C错误;
D.Cl2通入足量的NaOH溶液中发生反应:Cl2+2NaOH═NaCl+NaClO+H2O,由反应可知,1mol氯气完全反应转移1mol电子,通常状况下,不能用22.4L/mol计算11.2L氯气的物质的量,即11.2 L Cl2的物质的量不为0.5mol,则转移的电子数不为0.5NA,故D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②![]() ③
③![]() ④
④![]() ⑤CH≡C- CH3 ⑥聚乙烯
⑤CH≡C- CH3 ⑥聚乙烯
A.①②③④B.③④⑤C.①②⑤D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TPE(四苯基乙烯)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。TPE的结构简式如下图,下列关于TPE的说法正确的是( )
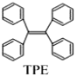
A.TPE的分子式为C26H22
B.TPE能发生加成反应,氧化反应,不能发生取代反应
C.TPE与化合物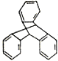 互为同分异构体
互为同分异构体
D.TPE的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 | 温度 | 反应物 | 催化剂 |
甲 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
乙 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
丙 | 40℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
(1)实验乙中发生反应的化学方程式为_______________。
(2)实验甲和实验乙的实验目的是____________。实验甲和实验丙的实验目的是___________。
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验乙 | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | |
0~20s的反应速率v1=__________mL/s,100~120s的反应速率v2=__________mL/s。不考虑实验测量误差,二者速率存在差异的主要原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。
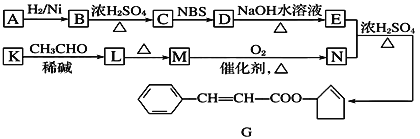
核磁共振氢谱显示A有两个峰,其强度之比为1∶1。
已知:![]()
![]()
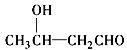
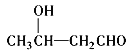
![]()
请回答下列问题:
(1)A的结构简式为________ ,G中官能团的名称为________。
(2)检验M已完全转化为N的实验操作是___________________。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,你认为是否合理______(填“是”或“否”)原因是________________________(若认为合理则不填此空)。
(4)写出下列转化的化学方程式,并标出反应类型:
K→L______________________________,反应类型________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种。(不考虑立体异构)
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上只有2个对位取代基
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选) ___________________________。
请用以下方式表示:A![]() B
B![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1NaOH溶液分别滴定20.00ml 0.100mol·L-1的盐酸和醋酸,滴定曲线如下图所示。下列说法正确的是( )

A. Ⅱ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于滴定盐酸消耗的V(NaOH)
C. V(NaOH)=10.00mL时,醋酸溶液中C(CH3COO-)+2C(H+)=C(CH3COOH)+2C(OH-)
D. V(NaOH)=20.00mL时,两份溶液中C(Cl-)=C(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
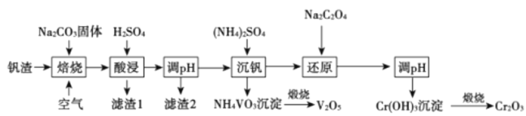
回答下列问题:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________和_______。
(2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______,NH4VO3煅烧过程中的化学方程式是______。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g) ![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 容器内压强不随时间变化B. 容器内,3种气体AB、A2、B2共存
C. 容器中各组分的体积分数不随时间变化D. AB的消耗速率等于A2的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
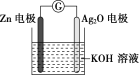
A.Zn电极是负极
B.Zn电极的电极反应式:Zn-2e-+2OH-=Zn(OH)2
C.Ag2O电极发生还原反应
D.放电前后电解质溶液的pH保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com