
【题目】在试管A中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。
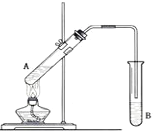
(1)试管B中盛放的溶液是_____________,其作用是:_____________
(2)反应的化学方程式是____________
(3)分离产物用的仪器是___________
【答案】饱和碳酸钠溶液 溶解乙醇、中和乙酸、降低乙酸乙酯的溶解度 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O 分液漏斗
CH3COOCH2CH3+H2O 分液漏斗
【解析】
乙醇与乙酸发生酯化反应,从试管A中挥发出的气体有乙酸、乙醇、乙酸乙酯等,分离获得乙酸乙酯需要用饱和碳酸钠溶液,然后再进行分液;
(1)乙醇、乙酸都易挥发,制备的乙酸乙酯中混有乙醇和乙酸,乙酸的酸性强于碳酸,乙醇溶于水,乙酸乙酯是微溶于水的液体,因此通常用饱和碳酸钠溶液溶解挥发出的乙醇,中和挥发出来的乙酸,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
(2)乙酸与乙醇在浓硫酸作用下加热发生酯化反应,生成乙酸乙酯和水,同时该反应为可逆反应,即反应方程式为CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(3)根据(1)的分析,试管B中液体出现分层,分离时采用分液的方法,即分离产物用到的仪器是分液漏斗。


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
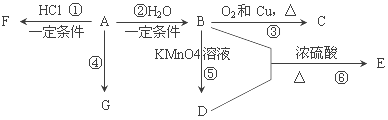
【题目】已知:A是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G之间的转化关系:
请回答下列问题:
(1)A的官能团的名称是_________;C的结构简式是_____;
(2)B是一种具有特殊香味的液体,由A→B的反应方程式为_____,该反应类型是_____;
(3)G 是一种高分子化合物,其结构简式是_____;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质F(沸点12.27°C)进行应急处理。写出由A制F的化学反应方程式_____。
(5)D的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物说法正确的是( )
A.可用酸性高锰酸钾溶液鉴别乙醇、环己烯与溴苯
B.![]() 是由小分子CH2==CH—CH3 和CH2==CH2 发生加聚反应的产物
是由小分子CH2==CH—CH3 和CH2==CH2 发生加聚反应的产物
C.石油裂解和油脂皂化都是由高分子化合物生成小分子物质的过程
D.淀粉与纤维素互为同分异构体,二者水解的最终产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。
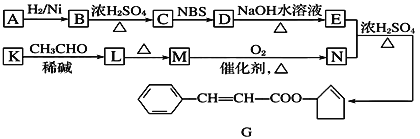
核磁共振氢谱显示A有两个峰,其强度之比为1∶1。
已知:![]()
![]()
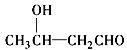
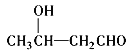
![]()
请回答下列问题:
(1)A的结构简式为________ ,G中官能团的名称为________。
(2)检验M已完全转化为N的实验操作是___________________。
(3)有学生建议,将M→N的转化用KMnO4(H+)代替O2,你认为是否合理______(填“是”或“否”)原因是________________________(若认为合理则不填此空)。
(4)写出下列转化的化学方程式,并标出反应类型:
K→L______________________________,反应类型________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有________种。(不考虑立体异构)
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上只有2个对位取代基
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选) ___________________________。
请用以下方式表示:A![]() B
B![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低
B. 利用电解法精炼粗铜时,精铜板做阴极,粗铜做阳极,CuSO4溶液做电解液
C. FeCl3溶液加热蒸干、灼烧得到Fe2O3
D. 用惰性电极电解MgCl2溶液,阴极得到单质Mg,阳极得到Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
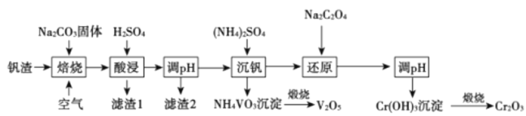
回答下列问题:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________和_______。
(2)滤渣1中主要含______。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______,NH4VO3煅烧过程中的化学方程式是______。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
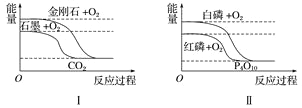
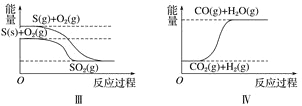
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
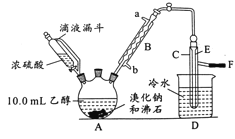
【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理为H2SO4(浓)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中进水口为__口(填“a”或“b”)。
(2)实验中用滴液漏斗代替分液漏斗的优点为__。
(3)氢溴酸与浓硫酸混合加热发生氧化还原反应的化学方程式__。
(4)给A加热的目的是__,F接橡皮管导入稀NaOH溶液,其目的是吸收__和溴蒸气,防止__。
(5)C中的导管E的末端须在水面以下,其原因是__。
(6)将C中的镏出液转入锥形并瓶中,连振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,使溶液分层后用分液漏斗分去硫酸层;将经硫酸处理后的溴乙烷转入蒸镏烧瓶,水浴加热蒸馏,收集到35~40℃的馏分约10.0g。
①分液漏斗在使用前必须__;
②从乙醇的角度考虑,本实验所得溴乙烷的产率是__(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com