
【题目】[Cu(NH3)4]SO4 是常见的配合物。请回答下列问题:
(1)中心阳离子的核外价电子排布式为_______,S、O、N三种元素的第一电离能由大到小的顺序为________。
(2)SO42-的空间立体构型是_____,与SO42-互为等电子体的一种非极性分子____(填化学式)。
(3)若不考虑空间构型,[Cu(NH3)4]2+的结构可用示意图表示为______(箭头表示出配位键)
(4)Cu2O比CuO更稳定,试从原子结构的角度解释其原因________________。
(5)新制氢氧化铜悬浊液常用于检验醛基的存在,乙醛分子中碳原子的杂化方式为______。
(6)Cu2O的晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)C为(![]() ,
, ![]() ,
, ![]() )。则D原子的坐标参数为____它代表____原子。
)。则D原子的坐标参数为____它代表____原子。
②若Cu2O晶胞的棱长是a cm, 阿伏加德罗常数值为NA,求该晶体的密度__________。
【答案】 3d9 N>O>S 正四面体 CCl4(或SiCl4等) ![]() Cu2+价层电子为3d9,3d10为全充满状态更稳定 sp3 、 sp2 (
Cu2+价层电子为3d9,3d10为全充满状态更稳定 sp3 、 sp2 (![]() ;
; ![]() ;
; ![]() ) Cu
) Cu ![]()
【解析】(1)中心阳离子是铜离子,铜的原子序数是29,则铜离子的核外价电子排布式为3d9;非金属性越强,第一电离能越大,氮元素的2p轨道电子处于半充满状态,稳定性强,则S、O、N三种元素的第一电离能由大到小的顺序为N>O>S。(2)SO42-中S的价层电子对数是4,不存在孤对电子,其空间立体构型是正四面体;原子数和价电子数分别都相等的是等电子体,则与SO42-互为等电子体的一种非极性分子是CCl4或SiCl4。(3)[Cu(NH3)4]2+中氮元素提供孤对电子,与铜形成配位键,则其结构可用示意图表示为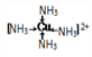 。(4)由于Cu2+价层电子为3d9,3d10为全充满状态更稳定,所以Cu2O比CuO更稳定;(5)乙醛分子的结构简式为CH3CHO,其中甲基中碳原子是饱和碳原子,是sp3杂化。醛基中碳原子形成碳氧双键,其杂化方式为sp2。(6)①根据晶胞结构和A、B、C的晶胞参数可知D原子的坐标参数为(1/4;1/4;1/4)。D原子全部在晶胞中,共计是4个,白球原子个数=8×1/8+1=2,根据氧化亚铜的化学式可知D代表Cu原子。②若Cu2O晶胞的棱长是a cm,阿伏加德罗常数值为NA,该晶体的密度=
。(4)由于Cu2+价层电子为3d9,3d10为全充满状态更稳定,所以Cu2O比CuO更稳定;(5)乙醛分子的结构简式为CH3CHO,其中甲基中碳原子是饱和碳原子,是sp3杂化。醛基中碳原子形成碳氧双键,其杂化方式为sp2。(6)①根据晶胞结构和A、B、C的晶胞参数可知D原子的坐标参数为(1/4;1/4;1/4)。D原子全部在晶胞中,共计是4个,白球原子个数=8×1/8+1=2,根据氧化亚铜的化学式可知D代表Cu原子。②若Cu2O晶胞的棱长是a cm,阿伏加德罗常数值为NA,该晶体的密度= 。
。


科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是
A. 使红色布条褪色(HCl)
B. 将NaHCO3固体加入新制氯水,有无色气泡(H+)
C. 向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D. 滴加AgNO3溶液生成白色沉淀(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Na2O2投入FeCl3溶液中,对观察到的现象描述准确的是
A.生成白色沉淀 B.生成红褐色沉淀
C.有气泡产生 D.生成红褐色沉淀、有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子
B. NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的
C. 对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高
D. 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A 元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 。
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式 ,1 mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填选项字母)。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③![]() 、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
、④HCHO。其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 。金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 cm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是 ( )
A. PH3分子中有未成键的孤对电子 B. PH3是非极性分子
C. 它的分子构型是平面三角形 D. 磷原子采用sp2杂化方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香酸类物质F常用做香精的调香剂。F的—种合成路线如下:
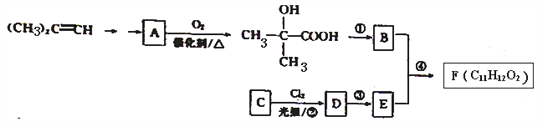
己知:A能发生银镜反应。回答下列问题:
(1)(CH3)2=CH2的化学名称为_________________,上述反应①、②、③、④中属于取代反应的有_______________。
(2)C的结构简式为_________,D中通过反应②引人的官能团名称为____________。
(3)①的反应条件是__________________。
(4)④的化学方程式为________________。
(5)B的同分异构体中,既能发生银镜反应又能发生水解反应的共有____种(不体异构),其中核磁共振氢谱显示为三组峰,且峰面积比为1:1:4的是________(填结构简式)。
(6)写出用(CH3)2C=CH2为原料(无机试剂任选)制备化合物A的合成路线:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com