
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源:不详 题型:单选题
| A.①②④⑤ | B.①②⑤⑦ | C.①②⑤⑥ | D.②⑤⑥⑦ |
查看答案和解析>>
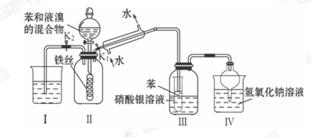
科目:高中化学 来源:不详 题型:实验题
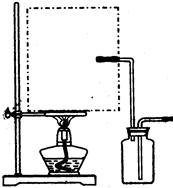


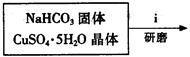
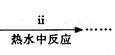
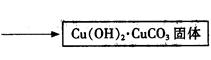
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
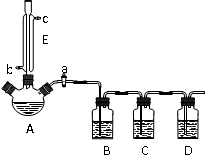
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
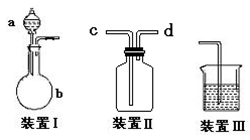
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2的尾气,可用NaOH溶液吸收 |
| B.NH3的尾气,可用H2SO4溶液吸收 |
| C.SO2的尾气,可用酸性KMnO4溶液吸收 |
| D.NO2的尾气,可用H2O来吸收 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
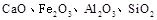 组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下:
组成,由榴石矿石制取氯化钙和氧化铝的实验步骤如下: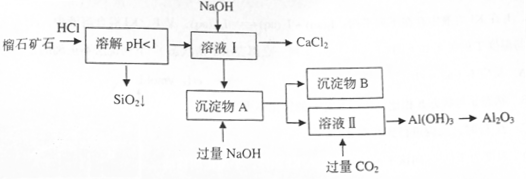
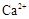 外,还含有的金属离子是 。
外,还含有的金属离子是 。
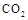 气体并通入溶液II中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为 。
气体并通入溶液II中,结果没有沉淀产生,可能的原是 ;为了能产生沉淀该同学对图I装置进行了改进,改进的方法为 。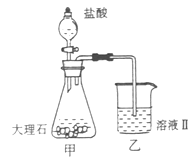
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com