
| ||
| A、CuFeS2中只有硫元素被氧化 |
| B、每生成1mol SO2,反应中共转移6mol电子 |
| C、该反应中有两种物质作氧化剂 |
| D、CuFeS2中被氧化和被还原的原子数目之比为2:1 |


科目:高中化学 来源: 题型:
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸钠的热稳定性小于碳酸氢钠的热稳定性 |
| C、二者都能与足量盐酸反应放出二氧化碳气体,等物质的量时,产生气体的量和反应快慢都不同 |
| D、二者在一定的条件下可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
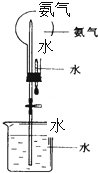 哈伯因为氨气的合成曾获1918年诺贝尔奖.
哈伯因为氨气的合成曾获1918年诺贝尔奖.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、Cl-、ClO- |
| B、NH4+、NO3-、Cl-、CO32- |
| C、K+、Ca2+、OH-、HCO3- |
| D、Al3+、NO3-、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、ICl3与水反应的产物为HI和HClO |
| B、ICl3与KI反应时,氯元素被还原 |
| C、ICl与冷NaOH溶液反应的离子方程式为:ICl+2OH-=IO-+Cl-+H2O |
| D、ICl与水的反应属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com