

 4NO+6H2O(2分)
4NO+6H2O(2分) 4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO; 该反应是放热,低温促进反应正向移 动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3NO2+H2O=2HNO3+NO;低温高压;
4NO+6H2O;(2)二氧化氮与水反应的化学方程式是:3NO2+H2O=2HNO3+NO; 该反应是放热,低温促进反应正向移 动,正反应气体体积减小,增大压强,反应正向移动,所以使吸收效果更好在吸收过程中需要控制低温高压下;故答案为:3NO2+H2O=2HNO3+NO;低温高压;

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.硫酸生产中常采用高压条件来提高SO2的转化率 |
| B.合成氨中采用及时分离液态氨来提高反应速率 |
| C.电解精炼铜中,溶液中c(Cu2+)基本保持不变 |
| D.氯碱工业中阳极得到氢氧化钠和氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
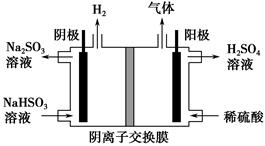
| 方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解饱和氯化钠溶液制备金属钠 |
| B.将氨气与二氧化碳先后通入饱和食盐水中,生成碳酸氢钠沉淀,再生成纯碱 |
| C.将氢气和氯气混合后点燃,产物用浓盐酸吸收制备盐酸 |
| D.将SO2和O2的混合气加压后,通过接触室制备SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| C.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
| D.生铁浸泡在食盐水中发生吸氧腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com