

 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑。即得到了纯碱Na2CO3。②侯氏制碱法与索尔维制碱法相比,优点是侯氏制碱法的工艺由制碱和制氯化铵两个过程组成,形成了纯碱与氯化铵的循环利用,减少了价值不大的CaCl2的生成。③有流程示意图可看出侯氏制碱法可以循环使用的物质有CO2、NaCl。(3)海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是防止阴极室的H2与阳极室C12混合发生爆炸,同时防止C12-进入阴极室,这样可以获得纯净的烧碱——NaOH。
Na2CO3+H2O+CO2↑。即得到了纯碱Na2CO3。②侯氏制碱法与索尔维制碱法相比,优点是侯氏制碱法的工艺由制碱和制氯化铵两个过程组成,形成了纯碱与氯化铵的循环利用,减少了价值不大的CaCl2的生成。③有流程示意图可看出侯氏制碱法可以循环使用的物质有CO2、NaCl。(3)海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是防止阴极室的H2与阳极室C12混合发生爆炸,同时防止C12-进入阴极室,这样可以获得纯净的烧碱——NaOH。

科目:高中化学 来源:不详 题型:填空题
| A.NH3 | B.CH4 | C.CO2 | D.H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.研制高温下活性较大的催化剂 |
| B.寻求NH3的新来源 |
| C.研制低温下活性较大的催化剂 |
| D.研制耐高温高压的新型材料建造合成塔 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KH2PO4和NH4Cl | B.NH4Cl和NH4NO3 |
| C.KNO3和KH2PO4 | D.NH4Cl和KNO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题


查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
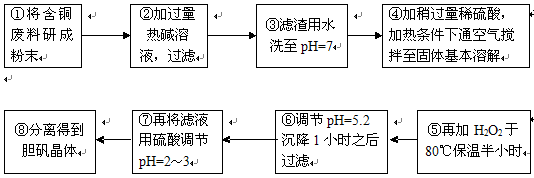
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com