
在55 ℃时,下列说法正确的是
A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变
B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L
C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO)
D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42 -)>c(NH4+ ) >c(H+)>c(OH-)
C
【解析】
试题分析:A.硫酸氢钠溶液完全电离,电离出的H+抑制水的电离,A项错误;B.Kw=1×10-14mol2/L2是在常温下的数值,而此时温度为55 ℃,无法确定Kw的值,进而无法计算OH-的浓度,B项错误;C.在饱和氯水中存在Cl2+H2O HCl+HCl0,根据物料守恒,c(Cl-)=c(ClO-)+c(HClO),C项正确;D.(NH4)2SO4溶液中存在(NH4)2SO4 =2NH4+ +SO42 -,所以c(NH4+ )>c(SO42 -),D项错误;选C。
HCl+HCl0,根据物料守恒,c(Cl-)=c(ClO-)+c(HClO),C项正确;D.(NH4)2SO4溶液中存在(NH4)2SO4 =2NH4+ +SO42 -,所以c(NH4+ )>c(SO42 -),D项错误;选C。
考点:考查电解质溶液中离子浓度的大小比较。
考点分析: 考点1:水的电离和溶液的酸碱性 考点2:盐类水解 试题属性

科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
对于铜锌原电池实验后得出的结论和认识中,正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极
C.电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气
D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三第二次模拟理综化学试卷(解析版) 题型:实验题
(15分)某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:

(1)溶解硼砂时需要的玻璃仪器有:烧杯和___________。
(2)用pH试纸测定溶液pH的操作方法为__________________________________。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为_________________________。
(4)实验流程中缺少的步骤a、步骤b操作分别为_________、_________。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:

滴定步骤为:

①滴定到终点时溶液颜色变化是______________________________________。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为__________________(假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____。(选填:“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期第一次月考理综化学试卷(解析版) 题型:选择题
下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.属于酯类的有4种
B.属于羧酸类的有2种
C.存在分子中含有六元环的同分异构体
D.既含有羟基又含有醛基的有3种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:填空题
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,

①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:实验题
(14分)半导体生产中常需要控制掺杂,以保证控制电阻率。三氯化磷(PCl3)是一种重要的掺杂剂。实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
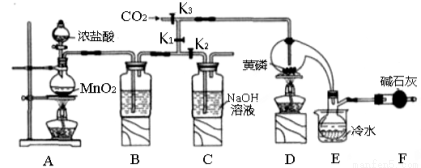
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生成 H3PO3和HC1。遇O2会生成POCl3,POCl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答下列问题:
(1)A装置中制氯气的离子方程式为 。
(2)B中所装试剂是 ,
E中冷水的作用是 ,
F中碱石灰的作用是____ 。_
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷。通干燥CO2的作用是 。
(4)粗产品中常含有POCl3、PCl5等。加入黄磷加热除去PCl5后.通过_____(填实验操作名称),即可得到较纯净的PCl3。
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00 g产品,加水反应后配成250 mL溶液;
②取以上溶液25.00 mL,向其中加入10.00 mL 0.1000 mol·L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000 mol·L-1的Na2S2O3,溶液滴定②重复②、③操作,平均消耗Na2S2O3,溶液8.40 mL
已知:H3PO3+H2O+I2 =H3PO4+2HI,I2+2Na2S2O3 = 2NaI+Na2S4O6,假设测定过程中没有其他反应。根据上述数据,该产品中PC13的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,有关说法正确的是

A.转移0.1 mol电子时,a电极产生1.12 L H2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e- = 2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省湛江市高三高考测试(一)理综化学试卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,下列叙述正确的是
X | |||
Y | Z | R | |
W | |||
A.Y单质在空气中燃烧生成YO3
B.Z元素的最高价氧化物的水化物酸性最强
C.X的氢化物为H2X
D.Y、Z和W的阴离子半径依次增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省莆田市高三质量检测化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,均含有相同的某种元素。在一定条件下它们之间存在如下转化关系:

下列说法中错误的是
A.甲可能是单质,也可能是化合物
B.丁可能是酸,也可能是碱
C.反应①②一定是氧化还原反应
D.反应③一定是化合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com