
【题目】如图甲是H2O2酶活性(v)受pH影响的曲线,图乙表示在最适温度下,pH=b时H2O2分解产生的O2量随时间(t)的变化。若该酶促反应过程中改变某一初始条件,以下改变正确的是( )
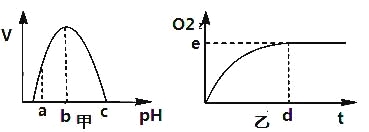
A. pH=c时,e点为0
B. pH=a时,e点不移,d点右移
C. 适当降低温度,e点下移,d点右移
D. H2O2量增加,e点不移,d点左移
【答案】B
【解析】试题分析:1、H2O2在常温下分解非常缓慢,在生物体内H2O2酶能将其快速分解.
2、分析曲线图:
图甲是H2O2酶活性受pH影响的曲线,pH=b时,该酶的活性最强;pH=c时,H2O2酶变性失活.
图乙表示在最适温度下,pH=a时,H2O2分解产生的O2量随时间的变化.e点表示化学反应的平衡点,d点表示到达平衡点所需的时间,能代表化学反应的速率.
解:A、pH=c时,酶变性失活,但H2O2在常温下也能缓慢分解,所以e点不变,d点右移,A错误;
B、pH=a时,酶的活性下降,酶促反应速率减慢,但化学反应的平衡点不变,所以e点不变,d点右移,B正确;
C、图乙表示在最适温度下,H2O2分解产生的O2量随时间的变化.温度降低时,酶的活性下降,酶促反应速率减慢,但化学反应的平衡点不变,所以e点不变,d点右移,C错误;
D、底物(H2O2量)增加时,化学反应的平衡点升高,到达化学反应平衡点所需的时间延长,即e点上移,d点右移,D错误.
故选:B.


科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。已知碱石灰的成分是氢氧化钠和氧化钙的混合物;炭与水蒸气在高温条件下发生以下反应:C + H2O(g)![]() CO + H2。回答下列问题:
CO + H2。回答下列问题:

(1)写出装置A中发生反应的离子方程式____________________。
(2)装置B中最适宜的试剂是________。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:____________。
(4)装置D中黑色固体为____(填名称),反应的化学方程式为____________。
(5)按照如图装置进行实验时,首先进行的操作是_____________。
(6)根据实验中的____________现象,可证明CO具有还原性,有关反应的化学方程式是_____________。
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置____与____之间连接下图中的__装置(填序号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。下图是用燃烧法确定有机物化学式常用的装置,该方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。

回答下列问题:
(1)A装置中发生反应的化学方程式为______________________________________,
(2)C装置(燃烧管)中CuO的作用是_______________________________________,
(3)写出E装置中所盛放试剂的名称_____________,
(4)将4.6 g有机物M进行实验,测得生成5.4 g H2O和8.8 g CO2,则该物质的实验式是________。
(5)经测定,有机物M的核磁共振氢谱示意图如图,则M的结构简式为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
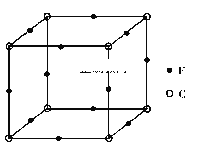
【题目】A、B、C、D、E、F是原子序数依次增大的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层电子均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为____________________________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为____________________。
(3)C、D、E元素的第一电离能由大到小排序_________________。(用元素符号表示)
(4)A和D形成的18电子化合物可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为___________________________。
(5)F与C形成化合物的晶胞如图所示,该化合物的化学式为__________,C离子的配位数是_________。此立方晶体的边长为a cm,则该晶体密度为__________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态铜原子价电子排布式为____________;第一电离能I(Cu)________I (Zn)(填“>”或“<”)
(2)配合物[Cu (CH3CN) 4] BF4[四氟硼酸四(乙腈)合铜(Ⅰ)]是有机合成中常见催化剂。
①该配合物中阴离子的空间构型为__________,与其互为等电子体的分子或离子是________(各举1例)。
②配体分子中与Cu(I) 形成配位键的原子为____________;配体CH3CN 中:碳原子杂化方式是______。
(3)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,Cu2O 属于____晶体,前者熔点较高,其原因是______________________________________________________________________________
(4)Cu3N 的晶胞(立方)结构如下图所示:
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
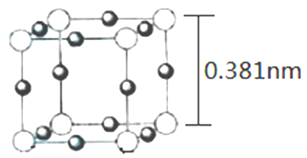
②Cu3N 晶体的密度为____________ g·cm-3。(列出计算式,不必计算出结果)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com