
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态铜原子价电子排布式为____________;第一电离能I(Cu)________I (Zn)(填“>”或“<”)
(2)配合物[Cu (CH3CN) 4] BF4[四氟硼酸四(乙腈)合铜(Ⅰ)]是有机合成中常见催化剂。
①该配合物中阴离子的空间构型为__________,与其互为等电子体的分子或离子是________(各举1例)。
②配体分子中与Cu(I) 形成配位键的原子为____________;配体CH3CN 中:碳原子杂化方式是______。
(3)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,Cu2O 属于____晶体,前者熔点较高,其原因是______________________________________________________________________________
(4)Cu3N 的晶胞(立方)结构如下图所示:
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
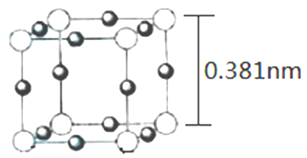
②Cu3N 晶体的密度为____________ g·cm-3。(列出计算式,不必计算出结果)
【答案】 3d104s1 < 正四面体 CCl4 PO43- SO42- ClO4- N sp sp3 离子 Cu+离子半径比K+小,晶格能大 0.27 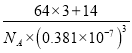 或
或![]()
【解析】试题分析:本题考查价电子排布式的书写、第一电离能大小的比较、空间构型的判断、等电子体的书写、晶体类型的判断和熔点高低的比较、晶胞的分析和计算。
(1)Cu的原子序数为29,Cu原子核外有29个电子,基态Cu原子的核外电子排布式为1s22s22p63s23p63d104s1,价电子排布式为3d104s1。Cu的价电子排布式为3d104s1,Zn的价电子排布式为3d104s2较稳定,所以第一电离能:I(Cu)![]() I(Zn)。
I(Zn)。
(2)①配合物中阴离子为BF4-,BF4-中中心原子B上的孤电子对数=![]() (3+1-4
(3+1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,VSEPR模型为正四面体型,由于B上没有孤电子对,BF4-的空间构型为正四面体型。用替代法,与其互为等电子体的分子有CF4、CCl4、SiF4等,离子有SO42-、PO43-、ClO4-等。
1)=0,成键电子对数为4,价层电子对数为0+4=4,VSEPR模型为正四面体型,由于B上没有孤电子对,BF4-的空间构型为正四面体型。用替代法,与其互为等电子体的分子有CF4、CCl4、SiF4等,离子有SO42-、PO43-、ClO4-等。
②配体CH3CN中N上有孤电子对,与Cu(I)形成配位键的原子为N。配体CH3CN的结构式为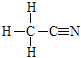 ,其中-CH3上C为sp3杂化,-CN上C为sp杂化。
,其中-CH3上C为sp3杂化,-CN上C为sp杂化。
(3)Cu2O的熔点较高,Cu2O属于离子晶体。Cu2O的熔点高于K2O的原因是:Cu2O和K2O都属于离子晶体,Cu+的离子半径小于K+的离子半径,Cu2O的晶格能大于K2O的晶格能,Cu2O的熔点高于K2O。
(4)用“均摊法”,晶胞中大白球的个数:8![]() =1个,小黑球:12
=1个,小黑球:12![]() =3,根据化学式Cu3N,大白球为N3-,小黑球为Cu+。
=3,根据化学式Cu3N,大白球为N3-,小黑球为Cu+。
①根据图示,距离最近的两个Cu+间的距离为![]() 0.381nm=0.27nm。
0.381nm=0.27nm。
②晶胞的体积为(0.381![]() 10-7)3cm3,1mol晶体的体积为NA
10-7)3cm3,1mol晶体的体积为NA![]() (0.381
(0.381![]() 10-7)3cm3=N
10-7)3cm3=N![]() 0.3813
0.3813![]() 10-21cm3,1mol晶体的质量为(3
10-21cm3,1mol晶体的质量为(3![]() 64+14)g=206g,Cu3N晶体的密度为
64+14)g=206g,Cu3N晶体的密度为![]() 1021g/cm3。
1021g/cm3。


科目:高中化学 来源: 题型:
【题目】如图甲是H2O2酶活性(v)受pH影响的曲线,图乙表示在最适温度下,pH=b时H2O2分解产生的O2量随时间(t)的变化。若该酶促反应过程中改变某一初始条件,以下改变正确的是( )
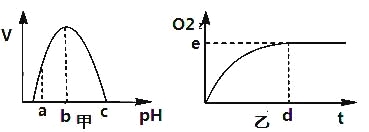
A. pH=c时,e点为0
B. pH=a时,e点不移,d点右移
C. 适当降低温度,e点下移,d点右移
D. H2O2量增加,e点不移,d点左移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述中正确的是
A.苯的结构中存在碳碳单键和碳碳双键
B.将苯加到溴水中,振荡、静置,上层几乎无色,下层为橙红色
C.苯分子中6个碳碳键完全相同
D.苯在催化剂作用下可以与液溴发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列三个图像:

下列反应中全部符合上述图像的反应是
A. N2(g) + 3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
B. 2SO3(g) ![]() 2SO2(g) +O2(g) △H>0
2SO2(g) +O2(g) △H>0
C. 2HI(g) ![]() H2(g) + I2(g) △H>0
H2(g) + I2(g) △H>0
D. 4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g) △H<0
4NO(g) + 6H2O(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时, 下列溶液中微粒浓度关系正确的是
A. 氨水稀释 10 倍后, 其 c(OH-)等于原来的![]()
B. pH=5 的 H2C2O4 溶液中: c(H+)=c(HC2O4 -)=1×10-5mol/L
C. pH 之和为 14 的 H2S 溶液与 NaOH 溶液混合: c(Na+)+c(H+)=c(OH-)+c(HS- )
D. (NH4)2SO4和 NaOH 混合所得的中性溶液中(不考虑 NH3): c(Na+)=c(NH3 ·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2007年9月,美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,这很可能是21世纪人类最伟大的发现之一,有望解决用水作人类能源的重大问题.无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧.上述中“结合力”实质是( )
A.分子间作用力B.氢键C.非极性共价键D.极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①.Cu ②.NaCl晶体 ③.NaHSO4 ④.CO2 ⑤.CaO ⑥HCl ⑦.稀H2SO4 ⑧. 熔融Ba(OH)2 ⑨.C2H5OH ⑩.NaCl溶液。
属于电解质的是(填序号,下同)_____,属于非电解质的是_____,能导电的是______。
(2)写出下列物质在水溶液中的电离方程式:
①NaHSO4 ___________________________;
②Al2(SO4)3 ________________________________;
③NH4NO3 ________________________。
(3)按要求写出下列方程式:
①写出硫酸铜溶液中滴加氢氧化钠溶液的反应的离子方程式:_____________。
②写出能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式:__________。
【答案】②③⑤⑥⑧ ④⑨ ①⑦⑧⑩ NaHSO4=Na++H++SO42- Al2(SO4)3=2Al3++3SO42- NH4NO3=NH4++NO3- Cu2++2OH-==Cu(OH)2↓ Na2CO3+2HCl=2NaCl+CO2↑+H2O(或其他)
【解析】
(1)在水溶液里或熔化状态下能够自身电离出离子的化合物是电解质,属于电解质的是NaCl晶体、NaHSO4、CaO、HCl、熔融Ba(OH)2,答案选②③⑤⑥⑧;在水溶液里和熔融状态下都不能自身电离出离子的化合物是非电解质,属于非电解质的是CO2、C2H5OH,答案选④⑨;含有自由移动电子或离子的物质可以导电,能导电的是Cu、稀H2SO4、熔融Ba(OH)2、NaCl溶液,答案选①⑦⑧⑩;(2)①NaHSO4在水溶液中的电离方程式为NaHSO4=Na++H++SO42-;②Al2(SO4)3在水溶液中的电离方程式为Al2(SO4)3=2Al3++3SO42-;③NH4NO3在水溶液中的电离方程式为NH4NO3=NH4++NO3-。(3)①硫酸铜溶液中滴加氢氧化钠溶液生成氢氧化铜沉淀和硫酸钠,反应的离子方程式为Cu2++2OH-==Cu(OH)2↓:②能用离子方程式CO32-+2H+=CO2↑+H2O表示的一个化学方程式可以是Na2CO3+2HCl=2NaCl+CO2↑+H2O。
点睛:化合物在水溶液中或受热熔化时本身能否发生电离是区别电解质与非电解质的理论依据,能否导电则是实验依据。因此能导电的物质不一定是电解质,如石墨;电解质本身不一定能导电,如NaCl晶体。
【题型】填空题
【结束】
27
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色A________,B____________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A_______________________;A→B____________________________。
(3)B→C可看到的现象是___________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性。下列叙述中不正确的是:
A. 红热的铜丝在氯气中剧烈燃烧,生成棕黄色烟
B. 钠在氯气中燃烧,生成白色的烟
C. 纯净的氢气在氯气中安静的燃烧,在集气瓶口形成白色烟雾
D. 氯气能与水反应生成盐酸和次氯酸,次氯酸见光易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁。某化学兴趣小组对绿矾的某一性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中通入氯气,溶液逐渐变红。由此可知硫酸亚铁的一些性质为:_________;此过程中涉及的反应离子方程式为_______________。
(2)为探究硫酸亚铁的分解产物,无水硫酸亚铁固体置于装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管A中残留固体为红色粉末。
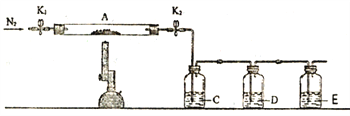
①C、D、E中的溶液依次为_______(填标号)。C、D中有气泡冒出,C、D中还可观察到的现象分别为________、________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出装置A中反应的化学方程式_____________。
③装置E的作用_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com