
【题目】现有下列三个图像:

下列反应中全部符合上述图像的反应是
A. N2(g) + 3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
B. 2SO3(g) ![]() 2SO2(g) +O2(g) △H>0
2SO2(g) +O2(g) △H>0
C. 2HI(g) ![]() H2(g) + I2(g) △H>0
H2(g) + I2(g) △H>0
D. 4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g) △H<0
4NO(g) + 6H2O(g) △H<0
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 分子的结构是由键角决定的
B. H2O分子中的两个O—H键的键角为180°
C. CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等
D. 共价键的键能越大,共价键越牢固,由该键形成的分子越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是( )




①除去CO2中HCl ②吸收Cl2 ③检查装置气密性 ④利用排空气法收集CO2
A. ①④ B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型实验因操作简单、装置小巧、安全可靠、减少污染等特点而被广泛应用,而且其原理和工业原理相同,图中所示是实验室中进行NH3的催化氧化实验的装置(附着在玻璃纤维上的Cr2O3做催化剂),图中的铁架台、酒精灯等已经略去,若化学药品可随便取用(尽可能按照实验室制气方法配制),则:

(1)若A中产生的气体遇到HCl 气体冒出白烟,叉型管中的固体物质A是_______, B 是_______。
(固体物质A、B可以是一种物质也可以是多种物质的混合物)
(2)C处发生 反应的化学方程式为______________,该反应中还原剂是_______;在工业 上,该反应要求气体_______(气体名称) 过量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态铜原子价电子排布式为____________;第一电离能I(Cu)________I (Zn)(填“>”或“<”)
(2)配合物[Cu (CH3CN) 4] BF4[四氟硼酸四(乙腈)合铜(Ⅰ)]是有机合成中常见催化剂。
①该配合物中阴离子的空间构型为__________,与其互为等电子体的分子或离子是________(各举1例)。
②配体分子中与Cu(I) 形成配位键的原子为____________;配体CH3CN 中:碳原子杂化方式是______。
(3)已知Cu2O 熔点为1235 ℃,K2O 熔点为770℃,Cu2O 属于____晶体,前者熔点较高,其原因是______________________________________________________________________________
(4)Cu3N 的晶胞(立方)结构如下图所示:
①距离最近的两个Cu+间的距离为________nm。(保留两位小数)
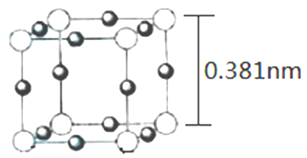
②Cu3N 晶体的密度为____________ g·cm-3。(列出计算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验。
(1)往A、B溶液中分别滴入几滴KSCN溶液,溶液的颜色A________,B____________。
(2)写出上述过程中有关反应的化学方程式:
Fe2O3→A_______________________;A→B____________________________。
(3)B→C可看到的现象是___________________________________________。
(4)将A的饱和溶液滴入沸水中并不断加热,可制得_______________胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为___________效应。
【答案】血红色 不变(浅绿色) Fe2O3+6HCl=2FeCl3+3H2O Fe+2FeCl3=3FeCl2 白色沉淀转变为灰绿色又转变为红褐色 Fe(OH)3 丁达尔
【解析】
(1)氧化铁与盐酸反应生成氯化铁,氯化铁与铁反应生成氯化亚铁,因此往A、B溶液中分别滴入几滴KSCN溶液,溶液A中显血红色,B中不变色;(2)Fe2O3与盐酸反应的方程式为Fe2O3+6HCl=2FeCl3+3H2O,A→B的方程式为Fe+2FeCl3=3FeCl2。(3)氯化亚铁与氢氧化钠反应生成氢氧化亚铁,氢氧化亚铁不稳定,易被氧化,所以B→C可看到的现象是白色沉淀转变为灰绿色又转变为红褐色。(4)将氯化铁饱和溶液滴入沸水中并不断加热,可制得氢氧化铁胶体;当光束通过该胶体时,可看到一条光亮的“通路”,这种现象称为丁达尔效应。
【题型】实验题
【结束】
28
【题目】现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题(由实验装置引起的实验误差忽略不计)。

I、探究浓硫酸的某些性质
(1)按图示连接装置,检查装置___________,称量E的质量。
(2)将aɡ铁碳合金样品放入A中,再加入适量的浓硫酸,仪器A的名称为______,未点燃酒精灯前,A、B 均无明显现象,其原因是______________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象,如A中![]() ,写出A中C和浓硫酸发生反应的化学方程式:__________________________,B中的现象是_________________,因此可得到浓硫酸具有_____________性。
,写出A中C和浓硫酸发生反应的化学方程式:__________________________,B中的现象是_________________,因此可得到浓硫酸具有_____________性。
(4)随着反应的进行,浓硫酸浓度逐渐减小变为稀硫酸,A中还可能发生某些离子反应,写出相应的离子方程式:_________________、____________________。
II、测定铁的质量分数
(5)待A中固体完全消失并不再逸出气体时,停止加热,拆下E并称重,E增重bg。铁碳合金中铁的质量分数为___________________(写表达式)。
(6)某同学认为上述方法较复杂,使用如图所示的装置和其他常用的实验仪器测定某些数据即可。为了快速和准确地计算出铁的质量分数,最简便的实验操作是___________(填写代号)。

①用排水法测定H2的体积
②反应结束后,过滤、洗涤、干燥、称量残渣的质量
③ 测定反应前后装置和药品的总质量ag
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com