
【题目】下列说法正确的是( )
A、在一定温度下AgCl水溶液中Ag+ 和Cl—浓度的乘积是一个常数
B、AgCl水溶液的导电性很弱,所以AgCl为弱电解质
C、温度一定时,当AgCl水溶液中Ag+ 和Cl—浓度的乘积等于KSP值时,此溶液为AgCl的饱和溶液
D、向饱和AgCl水溶液中加入盐酸,c(Cl—)增大,KSP值变大
科目:高中化学 来源: 题型:
【题目】有机物G是一种常用的植物调味油,可按如下路线合成:

已知:![]()
回答下列问题:
(1)下列关于乙烯的说法不正确的是_________(填字母)。
a.分子中所有原子共平面
b.能发生氧化反应,不能发生还原反应
c.能发生加聚反应生成高分子
d.能使酸性高锰酸钾溶液褪色
(2)由F生成G的反应类型为_________________________。
(3)C中官能团的名称为___________,由C生成D的反应类型为___________。
(4)D的化学名称为___________,由D生成E的化学方程式为___________。
(5)苯环上含有两个取代基,且分子中含有酯基的F的同分异构体有_________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是__________(填结构简式)。
(6)参照上述合成路线,设计以B为原料(无极试剂任选)制备高吸水性树脂![]() 的合成路线:________________。
的合成路线:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z均位于第二周期且两元素最外层电子数之和为11, Z、R同主族,M核外电子有26种运动状态,请回答下列问题:
(1)化合物XCl3中心原子的杂化轨道类型为_______;RC12的立体构型为________。
(2)H2Z、H2R的沸点分别为100℃、-60.4℃,试解释其原因:______________。
(3)R、M形成的一种化合物晶胞如图所示。

① 该化合物的化学式为________;
② 若晶胞参数为a pm。列式计算该晶胞的密度ρ=_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当物质发生化学反应时,断开反应物中的化学键要__________能量,而形成生成物中的化学键要__________能量,一个确定的化学反应的能量变化决定于反应物的总能量与生成物的总能量的相对大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述不涉及化学变化的是
A. 铁粉作袋装食品的抗氧化剂 B. 二氧化硫作纸浆的漂白剂
C. 氢氟酸作普通玻璃的刻蚀剂 D. 利用渗析实验除去淀粉溶液中的NaC1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含Fe3+而可能含有Fe2+,则进行如下实验操作的最佳顺序为( )
①加入少量氯水 ②加入少量KMnO4溶液 ③加入少量KSCN
A. ①③ B. ③② C. ③① D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
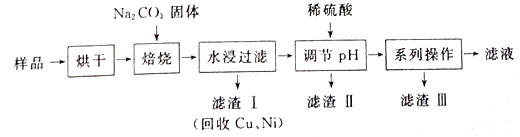
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
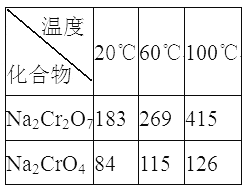
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1)“焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则因过量引起反应的离子方程式为______________________。
(3)“系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器一个盛有CO2,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的()
A. 原子总数
B. 质子总数
C. 分子总数
D. 质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学选修-物质结构与性质】
已知前四周期六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大,B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同.请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是______(填元素符号)
(2)化合物BD3的分子空间构型可描述为______,B的原子轨道杂化类型为______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输.已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物.则F的基态原子价电子排布式为______。CN-与______(一种分子)互为等电子体,则1个CN-中π键数目为______。
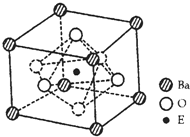
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为______,
在该晶体中,E4+的氧配为数为______。若该晶胞边长为anm可计算该晶体的密度为______g/cm3(阿伏加德罗常数为NA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com