
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
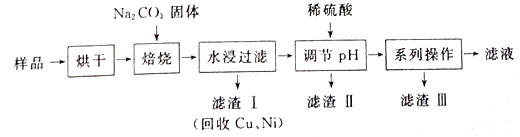
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
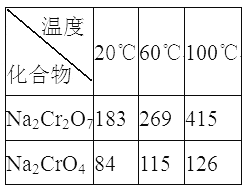
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1)“焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则因过量引起反应的离子方程式为______________________。
(3)“系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
【答案】 A12O3+NaCO3![]() 2NaAlO2+CO2↑ A1(OH)3+3H+==Al3++3H2O 蒸发浓缩 促进化学平衡2CrO42-+2H+
2NaAlO2+CO2↑ A1(OH)3+3H+==Al3++3H2O 蒸发浓缩 促进化学平衡2CrO42-+2H+![]() Cr2O72-+H2O向正反应方向移动,尽可能生成更多的Na2Cr2O7 Na2Cr2O7 Cr2O72-+14H++12e-==2Cr↓+7H2O
Cr2O72-+H2O向正反应方向移动,尽可能生成更多的Na2Cr2O7 Na2Cr2O7 Cr2O72-+14H++12e-==2Cr↓+7H2O ![]()
【解析】由已知,结合流程,以含有Cr(OH)3、Al2O3、CuO、NiO等物质的工业废料为原料,烘干后加入碳酸钠在空气中高温焙烧,发生反应4Cr(OH)3+4Na2CO3+3O2![]() 4Na2CrO4+6H2O+4CO2,Al2O3+Na2CO3
4Na2CrO4+6H2O+4CO2,Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,水浸后过滤得到滤渣CuO、NiO,滤液为Na2CrO4,NaAlO2等,调节溶液pH,沉淀偏铝酸根离子,过滤得到滤液Na2CrO4,加入硫酸酸化,生成重铬酸钠溶液,通过提纯得到重铬酸钠。
2NaAlO2+CO2↑,水浸后过滤得到滤渣CuO、NiO,滤液为Na2CrO4,NaAlO2等,调节溶液pH,沉淀偏铝酸根离子,过滤得到滤液Na2CrO4,加入硫酸酸化,生成重铬酸钠溶液,通过提纯得到重铬酸钠。
(1)由上述分析“焙烧”过程中生成NaAlO2化学方程式为:Al2O3+Na2CO3![]() 2NaAlO2+CO2↑。
2NaAlO2+CO2↑。
(2)加入适量稀硫酸调节溶液的pH除去A1O2-,得到A1(OH)3(滤渣II),若稀硫酸过量,A1(OH)3会反应,离子方程式为:A1(OH)3+3H+=Al3++3H2O。
(3)加入硫酸酸化,发生反应2CrO42-+2H+![]() Cr2O72-+H2O,生成重铬酸钠溶液,“系列操作”是为了提纯得到重铬酸钠,操作为:继续加入稀硫酸、蒸发浓缩、冷却结晶、过滤、洗剂、干燥等;继续加入稀硫酸是为了促进化学平衡2CrO42-+2H+
Cr2O72-+H2O,生成重铬酸钠溶液,“系列操作”是为了提纯得到重铬酸钠,操作为:继续加入稀硫酸、蒸发浓缩、冷却结晶、过滤、洗剂、干燥等;继续加入稀硫酸是为了促进化学平衡2CrO42-+2H+![]() Cr2O72-+H2O向正反应方向移动,尽可能生成更多的Na2Cr2O7;滤渣III的主要成分是:Na2Cr2O7。
Cr2O72-+H2O向正反应方向移动,尽可能生成更多的Na2Cr2O7;滤渣III的主要成分是:Na2Cr2O7。
(4)在“水浸过滤’’后的溶液中加人适量稀硫酸,生成重铬酸钠溶液,用石墨作电极电解生产金属铬,Cr2O72-在阴极发生得电子还原反应,+6价Cr变为0价,电极反应式为:Cr2O72-+14H++12e-=2Cr↓+7H2O。
(5)根据题意,取了滤液![]() 的进行滴定,即2×10-3L,由Na2Cr2O7+6FeSO4+7H2SO4=Na2SO4+Cr2(SO4)3+3Fe2(SO4)3 +7H2O得:n(Na2Cr2O7)=
的进行滴定,即2×10-3L,由Na2Cr2O7+6FeSO4+7H2SO4=Na2SO4+Cr2(SO4)3+3Fe2(SO4)3 +7H2O得:n(Na2Cr2O7)= ![]() n(FeSO4)=
n(FeSO4)= ![]() ×V×10-3L×c mol L-1,所以c(Na2Cr2O7)=
×V×10-3L×c mol L-1,所以c(Na2Cr2O7)= ![]() ×V×10-3L×c mol L-1÷2×10-3L=
×V×10-3L×c mol L-1÷2×10-3L=![]() molL-1。
molL-1。


科目:高中化学 来源: 题型:
【题目】用石墨电极a和石墨电极 电解NaNO3稀溶液的装置如图所示。通电后在两电极附近分别滴加几滴紫色石蕊试液。下列说法不正确的是

A. a电极逸出气体的体积大于b电极的
B. 溶液中的阴离子移向b电极
C. a电极附近溶液呈蓝色,b电极附近溶液呈红色
D. 若将a电极改为铜电极,b电极不变,则通电后a电极无气体逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是4种粒子的结构示意图:
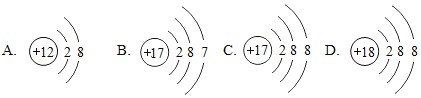
图中粒子共能表示_______种元素,图中表示的阳离子是____________(用离子符号表示),图中A所表示的元素在元素周期表中的位置_____________________________.
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
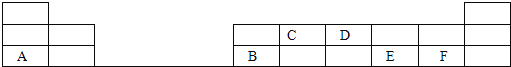
①写出D单质的电子式_____________________;
②写出C的最高价氧化物的结构式_____________________;
③E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________________;
④A最高价氧化物的水化物所含化学键为___________________,其晶体类型为________,其水溶液与B反应的离子方程式为___________________________;
(3)X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是 (______)
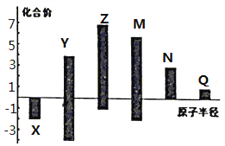
A.金属性:N>Q B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X D.原子序数:Z>M>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A、在一定温度下AgCl水溶液中Ag+ 和Cl—浓度的乘积是一个常数
B、AgCl水溶液的导电性很弱,所以AgCl为弱电解质
C、温度一定时,当AgCl水溶液中Ag+ 和Cl—浓度的乘积等于KSP值时,此溶液为AgCl的饱和溶液
D、向饱和AgCl水溶液中加入盐酸,c(Cl—)增大,KSP值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书》记载“高奴县有洧水可燃”,《梦溪笔谈》描述“洧水”是“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”。这里的“洧水”和“烟”是指
A. 汽油和炭黑 B. 石油和炭黑 C. 煤油和石墨 D. 油脂和焦炭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】韩国三星公司因为手机电池爆炸而屡屡曝光,电池的安全性和环保性再次被公众所重视。一种以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是

A. N极为电源负极,联氨从c口通入
B. 负极上每消耗lmol N2H4,转移6mol电子
C. 正极的电极反应式为:O2+2H2O+4e-==4OH-
D. 可将联氨改进为引火性低、稳定性好的N2H4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件(温度、反应物用量、反应物浓度等)改变,不会引起产物改变的是( )
A. Na2O2和CO2 B. NaOH和CO2
C. Na和O2 D. Cu和HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的废渣中混有少量的锌粉和氧化铜(其他成分不跟酸反应),跟大量废盐酸接触形成污水,产生公害。若向污水中撒入铁粉且反应后铁粉有剩余,此时污水中一定含有的金属离子是
A.Fe2+、Cu2+ B. Cu2+ 、 H+ C. Zn2+ 、Fe2+ D. Zn2+ 、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下: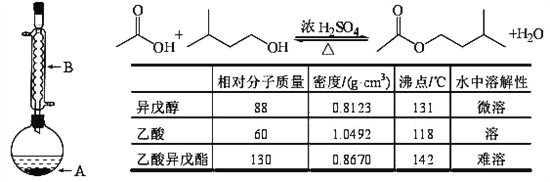
实验步骤:
①在A中加入 4.4 g的异戊醇, 6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A 50分钟,②反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,③分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,④进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯 3.77 g。回答下列问题:
(1)异戊醇的系统命名法名称是:________________,
(2)装置B的作用:_____________,
(3)在步骤①中加入过量乙酸的目的是:_____________,
(4)在步骤②洗涤操作中,第一次水洗可以大量洗去的杂质有:___________,
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后,先将______从分液漏斗的下口放出,再将______从上口放出,
(6)在步骤③中加入少量无水硫酸镁的目的是:_______________,
(7)本实验的产率是:______,
(8)在步骤④中,若从 130℃开始收集馏分,产率将偏_______(填高或者低)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com