
【题目】(1)下面是4种粒子的结构示意图:
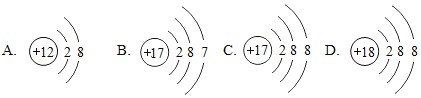
图中粒子共能表示_______种元素,图中表示的阳离子是____________(用离子符号表示),图中A所表示的元素在元素周期表中的位置_____________________________.
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
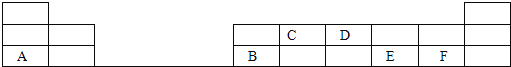
①写出D单质的电子式_____________________;
②写出C的最高价氧化物的结构式_____________________;
③E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________________;
④A最高价氧化物的水化物所含化学键为___________________,其晶体类型为________,其水溶液与B反应的离子方程式为___________________________;
(3)X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是 (______)
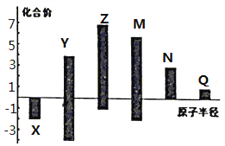
A.金属性:N>Q B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X D.原子序数:Z>M>X>Y
【答案】 3 Mg2+ 第三周期第IIA族 ![]() O=C=O HCl 离子键 和 共价键 离子晶体 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑ BD
O=C=O HCl 离子键 和 共价键 离子晶体 2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑ BD
【解析】(1)质子数相同,为同种元素,故上图中表示四种元素;阳离子中质子数大于核外电子数所以B是阳离子,是镁离子,离子符号为:Mg2+;A和E质子数相同都为17,都是氯元素,氯元素位于元素周期表的第三周期。
(2)根据元素在周期表中的分布,可知A是Na,B是Al,C是C,D是N,E是S,F是Cl。
①D单质(N2)的电子式为![]() ;②C的最高价氧化物(CO2)的结构式为O=C=O;③同周期元素的原子从左到右,氢化物的稳定性逐渐增强,所以E和F分别形成的气态氢化物(H2S和HCl)中较稳定的是(填写氢化物的化学式):HCl;④A最高价氧化物的水化物(NaOH)所含化学键为离子键和共价键;其晶体类型为离子晶体,其水溶液与B(Al)反应的离子方程式为2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑。
;②C的最高价氧化物(CO2)的结构式为O=C=O;③同周期元素的原子从左到右,氢化物的稳定性逐渐增强,所以E和F分别形成的气态氢化物(H2S和HCl)中较稳定的是(填写氢化物的化学式):HCl;④A最高价氧化物的水化物(NaOH)所含化学键为离子键和共价键;其晶体类型为离子晶体,其水溶液与B(Al)反应的离子方程式为2Al + 2OH - + 2H2O = 2AlO2- + 3H2↑。
(3)由图知X化合价为-2价,没有正价,故X为O元素;M的化合价为+6价、-2价,故M为S元素;Z的最高正价为+7价、最低为-1价,故Z为Cl元素;Y的化合价为+4价、-4价,原子半径小于Cl,故Y为C元素;N为+3价,原子半径大于S,故N为Al元素;Q为+1价,处于IA族,原子半径大于Al,故Q为Na元素。A项,同周期从左向右金属性减弱,故金属性Na>Al,A错误;B项,非金属性越强,最高价氧化物对应的水化物的酸性越强,故H2SO4>H2CO3>HAlO2,B正确;C项,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,C错误;D项,原子序数Z(Cl)>M(S)>X(O)>Y(C),D正确。故选BD。


科目:高中化学 来源: 题型:
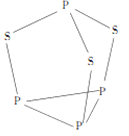
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为____________。
(2)第一电离能:S______(填“>”、“<”或“=”,下同)P,电负性:S_____P。
(3)三硫化四磷分子中P原子采取_________杂化,与PO3-互为等电子体的化合物分子的化学式为_______。
(4)二硫化碳属于________(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。
(6)叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_____________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为αcm,晶胞中Na+的配位数为______,用NA表示阿伏加德罗常数的数值,NaOH的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用浓盐酸与二氧化锰在加热的条件下反应生成二氯化锰与氯气,纯净的氯气和铁粉反应制取少量氯化铁固体,其反应装置示意图如图,回答下列问题:
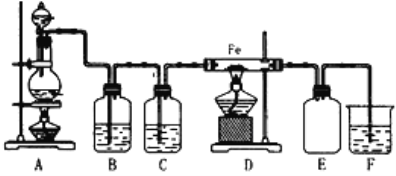
(1)A装置可制取氯气,反应前分液漏斗中药品为__.
(2)写出A装置中制取氯气所发生的化学方程式是__.
(3)装置B中盛放的试剂是__.
(4)装置E的作用是__.
(5)装置C的作用是__.
(6)装置F中发生反应的化学方程式是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、M是原子序数依次增大的五种元素,基态X原子的s电子数比p电子数多3个,Y、Z均位于第二周期且两元素最外层电子数之和为11, Z、R同主族,M核外电子有26种运动状态,请回答下列问题:
(1)化合物XCl3中心原子的杂化轨道类型为_______;RC12的立体构型为________。
(2)H2Z、H2R的沸点分别为100℃、-60.4℃,试解释其原因:______________。
(3)R、M形成的一种化合物晶胞如图所示。

① 该化合物的化学式为________;
② 若晶胞参数为a pm。列式计算该晶胞的密度ρ=_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活联系紧密,下列有关说法正确的是
A. 只用淀粉溶液即可检验食盐是否为加碘盐
B. 氢氟酸刻蚀水晶饰品体现其酸性
C. 水垢中的CaSO4,可先转化为CaCO3,再用酸除去
D. 煤经过气化和液化等物理变化可转为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当物质发生化学反应时,断开反应物中的化学键要__________能量,而形成生成物中的化学键要__________能量,一个确定的化学反应的能量变化决定于反应物的总能量与生成物的总能量的相对大小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述不涉及化学变化的是
A. 铁粉作袋装食品的抗氧化剂 B. 二氧化硫作纸浆的漂白剂
C. 氢氟酸作普通玻璃的刻蚀剂 D. 利用渗析实验除去淀粉溶液中的NaC1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业废料料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。
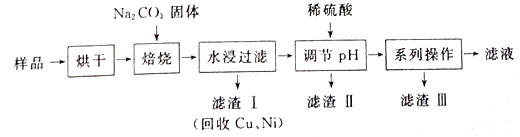
已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物质
②除去滤渣II后,溶液中存在反应2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
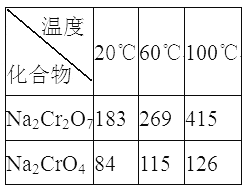
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
(1)“焙烧”过程中生成NaAlO2化学方程式为_____________________。
(2)生成滤渣II时,需加入适量稀硫酸调节溶液的pH除去A1O2-。若稀硫酸过量,则因过量引起反应的离子方程式为______________________。
(3)“系列操作”为:继续加入稀硫酸、_____、冷却结晶、过滤。继续加入稀硫酸的目的是_____________,滤渣III的主要成分是_________(填化学式)。
(4)工业上还可以在“水浸过滤’’后的溶液中加人适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为______________。
(5)流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20mL,水稀释至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol L-1的FeSO4溶液进行氧化还原滴定,到终点时消耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(未配平)],则“滤液”中的(Na2Cr2O7)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是 ( )

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c、d、e四种元素中都存在能促进水的电离的含氧酸盐
D. e和其它四种元素均能形成共价化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com