
����Ŀ������������������۷���Ϣ���ʵijɷ�֮һ�������㽶����ζ��ʵ�����Ʊ������������ķ�Ӧװ��ʾ��ͼ���й��������£�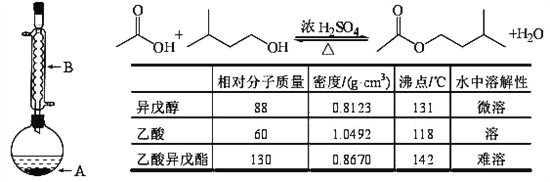
ʵ�鲽�裺
����A�м��� 4.4 g�����촼�� 6.0 g�����ᡢ����Ũ�����2��3Ƭ���Ƭ����ʼ��������A 50���ӣ��ڷ�ӦҺ�������º����Һ©���У��ֱ�������ˮ������̼��������Һ��ˮϴ�ӣ��۷ֳ��IJ������������ˮ����þ���壬����Ƭ�̣����˳�ȥ����þ���壬�ܽ����������ռ�140��143����֣������������� 3.77 g���ش��������⣺
��1�����촼��ϵͳ�����������ǣ�________________��
��2��װ��B�����ã�_____________��
��3���ڲ�����м�����������Ŀ���ǣ�_____________��
��4���ڲ����ϴ�Ӳ����У���һ��ˮϴ���Դ���ϴȥ�������У�___________��
��5����ϴ�ӡ���Һ�����У�Ӧ�����Ȼ���ã����ֲ���Ƚ�______�ӷ�Һ©�����¿ڷų����ٽ�______���Ͽڷų���
��6���ڲ�����м���������ˮ����þ��Ŀ���ǣ�_______________��
��7����ʵ��IJ����ǣ�______��
��8���ڲ�����У����� 130�濪ʼ�ռ���֣����ʽ�ƫ_______(����ߵ�)��
���𰸡� 3-��-1-���� ������������ߴ���ת���� ���� ���� ˮ�� ���������� ���� 58�G ��
����������1�����촼�Ľṹ��ʽΪ![]() ��ϵͳ������������ 3-��-1-��������2��װ��B�����������������ܣ���������������������3��������Ӧ�ǿ��淴Ӧ������Ӧ���Ũ�ȿ���ʹƽ�������ƶ�������һ�ַ�Ӧ���Ũ�ȣ�����ʹ��һ�ַ�Ӧ���ת������ߡ���˱�ʵ���м�����������Ŀ������ߴ���ת���ʣ���4����Ӧ�����ҺҪ�������ϴ�ӣ���ϴ�Ӳ����У���һ��ˮϴ����ҪĿ���dz�ȥ�ִ��������δ��Ӧ�Ĵ����5�����������ܶȱ�ˮС�����������ܣ����ˮ���²㣬�����ϲ㡣��Һʱ��Ҫ�Ƚ�ˮ��ӷ�Һ©�����¿ڷų�����������Һ�����ʱ�رշ�Һ©���Ļ������ٽ��������������Ͽڷų�����6��ʵ���м���������ˮ����þ��Ŀ��������������������ˮ�֣������7��n�����ᣩ��6.0g��60g/mol��0.1mol��n�����촼����4.4g��88g/mol��0.05mol�����ڶ��߷�Ӧ��1:1��Ӧ�ģ������������Ҫ���մ������㡣n��������������= 3.77 g��130g/mol=0.029mol�����Ա�ʵ��IJ�����0.029mol��0.05mol��100�G��58�G����8���ڽ����������ʱ������130 �濪ʼ�ռ���֣���ʱ�������к��д������ռ�������δ��Ӧ�����촼����˲���ƫ�ߡ�
��ϵͳ������������ 3-��-1-��������2��װ��B�����������������ܣ���������������������3��������Ӧ�ǿ��淴Ӧ������Ӧ���Ũ�ȿ���ʹƽ�������ƶ�������һ�ַ�Ӧ���Ũ�ȣ�����ʹ��һ�ַ�Ӧ���ת������ߡ���˱�ʵ���м�����������Ŀ������ߴ���ת���ʣ���4����Ӧ�����ҺҪ�������ϴ�ӣ���ϴ�Ӳ����У���һ��ˮϴ����ҪĿ���dz�ȥ�ִ��������δ��Ӧ�Ĵ����5�����������ܶȱ�ˮС�����������ܣ����ˮ���²㣬�����ϲ㡣��Һʱ��Ҫ�Ƚ�ˮ��ӷ�Һ©�����¿ڷų�����������Һ�����ʱ�رշ�Һ©���Ļ������ٽ��������������Ͽڷų�����6��ʵ���м���������ˮ����þ��Ŀ��������������������ˮ�֣������7��n�����ᣩ��6.0g��60g/mol��0.1mol��n�����촼����4.4g��88g/mol��0.05mol�����ڶ��߷�Ӧ��1:1��Ӧ�ģ������������Ҫ���մ������㡣n��������������= 3.77 g��130g/mol=0.029mol�����Ա�ʵ��IJ�����0.029mol��0.05mol��100�G��58�G����8���ڽ����������ʱ������130 �濪ʼ�ռ���֣���ʱ�������к��д������ռ�������δ��Ӧ�����촼����˲���ƫ�ߡ�


 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д� �ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
�ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҵ�������к���Cr(OH)3��Al2O3��CuO��NiO�����ʣ���ҵ��ͨ���������̻����������õĽ�������ȡNa2Cr2O7��
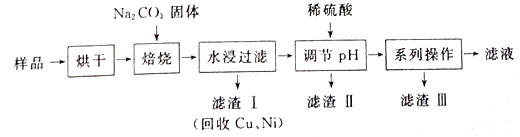
��֪��
�١�ˮ�����ˡ������Һ�д���Na2CrO4��NaAlO2������
�ڳ�ȥ����II����Һ�д��ڷ�Ӧ2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
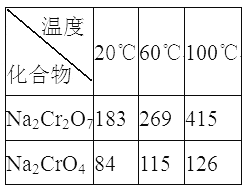
��Na2Cr2O7��Na2CrO4�ڲ�ͬ�¶��µ��ܽ�ȣ�g/100 g H2O)���±���
(1)�����ա�����������NaAlO2��ѧ����ʽΪ_____________________��
(2)��������IIʱ,���������ϡ���������Һ��pH��ȥA1O2-����ϡ��������������������Ӧ�����ӷ���ʽΪ______________________��
(3)��ϵ�в�����Ϊ����������ϡ���ᡢ_____����ȴ�ᾧ�����ˡ���������ϡ�����Ŀ����_____________������III����Ҫ�ɷ���_________(�ѧʽ)��
(4)��ҵ�ϻ������ڡ�ˮ�����ˡ��������Һ�м�������ϡ���ᣬ��ʯī���缫��������������������ĵ缫��ӦʽΪ______________��
(5)����ͼ���ġ���Һ������Ȼ�в�����Na2Cr2O7��CrΪ�ؽ���Ԫ�أ����������߾���������У���Ժ�ˮ����ؽ�����Ⱦ��Ϊ�ⶨ����Һ���е�c(Na2Cr2O7)��ijʵ��С��ȡ����Һ��20mL��ˮϡ����250 mL����ȡϡ�ͺ����Һ25 mL����ƿ�У���c mol L-1��FeSO4��Һ����������ԭ�ζ������յ�ʱ����FeSO4��Һ���ΪV mL[��֪�����ķ�ӦΪNa2Cr2O7 + FeSO4 + H2 SO4![]() Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(δ��ƽ)]������Һ���е�(Na2Cr2O7)=______mol��L-1��
Na2SO4+ Cr2(SO4) 3 + Fe2(SO4)3 + H2O(δ��ƽ)]������Һ���е�(Na2Cr2O7)=______mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ص�ԭ����������ij�ֳ������ϼ۵Ĺ�ϵͼ������ԭ��������������Ӧ��Ԫ�أ�������˵����ȷ���� (�� ��)

A. 31d��33d����ͬ�ֺ���
B. ��̬�⻯����ȶ��ԣ�a��d��e
C. b��c��d��e����Ԫ���ж������ܴٽ�ˮ�ĵ���ĺ�������
D. e����������Ԫ�ؾ����γɹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧѡ�ޣ����ʽṹ�����ʡ�
��֪ǰ����������Ԫ��A��B��C��D��E��F��ԭ������֮��Ϊ107�������ǵĺ˵������������Bԭ�ӵ�p�������������⻯��е���ͬ��Ԫ������͵ģ�Dԭ�ӵõ�һ�����Ӻ�3p���ȫ������A��C���γ�A2C�����ӻ�������е��������������һ�����Ӳ㣬E4+���Ӻ��ԭ�ӵĺ�������Ų���ͬ����ش��������⣺
(1)A��B��C��D�ĵ�һ��������С�����˳����______����Ԫ�ط��ţ�
(2)������BD3�ķ��ӿռ乹�Ϳ�����Ϊ______��B��ԭ�ӹ���ӻ�����Ϊ______��
(3)��֪FԪ���������ں���ƫ��ʱ����Ӱ��O2�����ڵ��������䣮��֪F2+��KCN��Һ��Ӧ��F��CN��2���������������KCN��Һʱ�����ܽ⣬����������F�Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ______��CN-��______��һ�ַ��ӣ���Ϊ�ȵ����壬��1��CN-��������ĿΪ______��
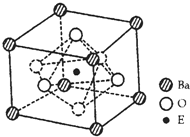
(4)EO2��̼�ᱵ������״̬�·�Ӧ�����þ���ľ����ṹ��ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ______��
�ڸþ����У�E4+������Ϊ��Ϊ______�����þ����߳�Ϊanm�ɼ���þ�����ܶ�Ϊ______g/cm3�������ӵ�����ΪNA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��һ����̬����B��D�����������ֳ������л����AΪ��Ҫԭ�Ϻϳ��������������г�·������ͼ��ʾ��

��1��A�Ʊ�B�ķ���ʽΪ:______________________________
��2��B���Ʒ�Ӧ�Ļ�ѧ�ų�ʽΪ:______________________________������B���Ʒ�Ӧ�Ʊ����������Ƶ�1molH2��ҪB__________mol��
��3������B�ڿ����п��Ա�����ΪC���˹��̵ķ���ʽΪ____________________��
��4��������뺬���ᡢ�Ҵ���ˮ�����������ֲ�Ʒ����ͼ�Ƿ��������������ͼ��ͼ��Բ���ű�ʾ�����ʵ����Լ�����ű�ʾ�ʵ��ķ��뷽����

��д��������Լ���a����__________����b����__________��
��д���йصIJ������뷽��:����__________������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��Xλ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ1��Ԫ��Y��̬ԭ�ӵ�3p�������5�����ӣ�Ԫ��Z��ԭ�����������������ڲ��3����Ԫ��W��̬ԭ�ӵĺ�����ӹ���16���˶�״̬��
��1������Ԫ�����ڱ��У�Ԫ��Xλ�� ����Ԫ��Yλ�ڵ� ���ڵ� �塣
��Z���������У���һ����������Ԫ���� ����Ԫ�����ƣ���
��X+�ĺ�������Ų�ʽΪ ��
��Y��W��Ԫ������������Ӧ��ˮ�������Խ�ǿ���� ���ѧʽ����
��2��X��Y���γɻ����ᄃ��ľ�����ͼ��ʾ����1�������У�X���ӵ���ĿΪ ���û�����Ļ�ѧʽΪ ��
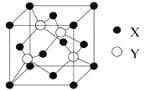
��3�������Ҵ��е��ܽ�ȣ�Z���⻯��(H2Z)����H2W������Ҫԭ���� ��
���ȶ��ԣ� H2Z H2W����������������������=����������Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��M��N��������Ԫ�������������ڱ���λ����ͼ��ʾ������˵������ȷ����(����)

A. ԭ�Ӱ뾶��Y>Z>W
B. ���ʵĻ�ԭ����X>Y
C. ����Ԫ��Mͬ����������������ˮ��������Ա�M��ǿ
D. Ԫ��Nλ�ڽ�����ǽ����ķֽ��߸����������ƶ�NԪ�صĵ��ʿ����뵼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������DZˮͧ������ɴ�������������
A. ������ B. �Ȼ��� C. �������� D. ̼����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com