
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):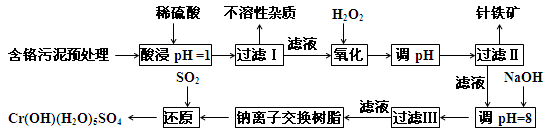
常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)升高温度、搅拌、延长浸取时间、过滤后再次浸取(其他合理答案也可)(1分);
(2)Fe2+(1分), 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O(2分), FeO(OH) (1分);
(3)Al3+、Cu2+(1分), Al(OH)3 + OH- = AlO2- + 2H2O(2分),
AlO2- + 2H2O + CO2 = Al(OH)3↓+ HCO3- (2分)
(4)1 ,3 ,11, 2 ,1(2分), 3NA(2分)(或1.806´1024);
解析试题分析:流程的初期为酸浸,使工业污泥中的物质充分溶解,为提高效率可采取“升高温度、搅拌、延长浸取时间、过滤后再次浸取”的措施;结合题给的图表,确定过氧化氢的作用是氧化Fe2+,其反应的离子方程式为 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;由针铁矿的化学式量89,可确定其化学式为FeO(OH);调节p H=8时Al3+、Cu2+全部沉淀,加入NaOH,可发生反应Al(OH)3 + OH- = AlO2- + 2H2O;通入CO2时发生反应AlO2- + 2H2O + CO2 = Al(OH)3↓+ HCO3- ;由得失电子守恒配平氧化还原反应方程式,并计算转移的电子数。
考点:本题以工艺流程为情景,结合元素化合物的性质,考查了氧化还原反应及其方程式的配平和计算。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:填空题
(16分) 以电解法生产金属锰产生的阳极泥中,其锰含量高达40%~50%,主要成分为MnO2的水合物,且含有显著量的Pb2+、Sn2+等重金属杂质。本工艺采用的木屑富含的纤维素在较浓硫酸的作用下膨胀、水解生成还原糖,酸性条件下,可与二氧化锰反应生成可溶性的硫酸锰。

(1)工业上电解硫酸锰的水溶液生产金属锰,阳极的电极反应式为 。
(2)写出木屑水解反应的化学方程式: 。配平浸出步骤反应方程式C6H12O6 + MnO2 + H2SO4→ MnSO4 + CO2 + H2O
(3)若取消除酸操作步骤,将会产生 气体(填化学式)而污染环境;
(4)本工艺的一种副产品是重要的农业生产资料,写出其化学式 ;
(5)取一定量的阳极泥进行实验分析,得到如下图像。硫酸的最合适用量为 mL,若再增加硫酸的用量,将会导致 (填化学式)的消耗量增大。
(6)某阳极泥中MnO2(相对分子质量为87)的质量分数为50.0%,将174g该阳极泥与320g36.5%的浓盐酸混合加热,则产生的氯气在标准状况下应少于 L。(假设阳极泥中的其它成分不参与反应)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭按一定比例混合而成的,爆炸时会产生N2、CO2等。
(1)爆炸时的化学方程式为: 。(2分)
(2)在黑火药爆炸的反应中硫作氧化剂,在一些反应中硫也可以作还原剂,写出一个硫在反应中作还原剂的化学方程式: 。(2分)
(3)氮气在放电条件下与氧气反应的化学方程式: 。(2分)
(4)一氧化氮、二氧化氮都是氮氧化物。一氧化氮在常温下很容易与空气中的氧气化合,化学方程式为: 。(2分)二氧化氮能与水反应,化学方程式为: 。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e-=NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出该氧化还原反应的化学方程式:________。
(2)反应中硝酸体现了________、________。
(3)反应中若产生标准状况下11.2L气体,则转移电子的物质的量是________ mol。
(4)现称取含有杂质的甲样品(杂质与酸不反应)5.4 g,恰好与100 mL 1.4 mol·L-1的硝酸溶液完全反应,则该样品的纯度为________。
(5)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= __。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为 。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4
c.(NH4) 2SO4 d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为 __(填选项字母)。
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 __。
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为 __,电解过程中阴极附近溶液的pH将 __(填“增大”“减小”或“不变”)。
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 __为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应) __(列式并计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| | X | Y | Z |
| W | | | |

 。
。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s)=6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)=CaSiO3(s) ΔH1=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)=6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3=________kJ·mol-1。
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________。
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。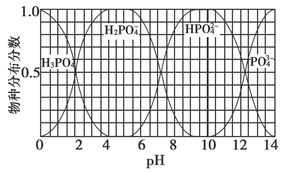
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________。
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示)。
(4)磷的化合物三氯氧磷( )与季戊四醇(
)与季戊四醇(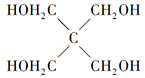 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: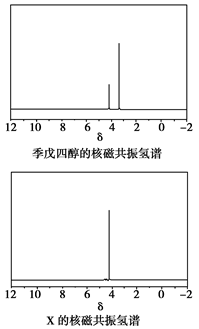
①酸性气体是______________________(填化学式)。
②X的结构简式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为: 
(1)该盐酸的物质的量浓度为 mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目 。
(3)8.7gMnO2能使 molHCl被氧化。
Ⅱ.在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原
的硫酸为 0.9 mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com