
某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g) 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K=
B.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大
C.增大该体系的压强,A的转化率增大
D.该条件下B的平衡转化率是40%
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
①c1合理的数值为 。(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)= 。
③不能作为判断该反应达到平衡状态的标志是 。(填字母标号)
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:

实验 编号 | T/oC | NO初始浓 度/10-3mol·L-1 | CO初始浓 度/10-3mol·L-1 | 催化剂的比 表面积/m2·g-1 |
① | 350 | 1.20 | 5.80 | 124 |
② | 280 | 1.20 | 5.80 | 124 |
③ | 280 | 1.20 | 5.80 | 82 |
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为 。
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K= 。
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650oC下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是

A.X元素可能为Al
B.X元素不一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:填空题
选考[化学——选修3:物质结构与性质] (13分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的价电子排布式 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O、P、S元素第一电离能由小到大的顺序为 。及电负性由小到大的顺序为 。
(2)氨基乙酸铜的分子结构如图,氮原子的杂化方式为 。

(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为 。
(4)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
1.92 g Cu投入一定量的浓HNO3溶液中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下的气体672 mL,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入的氧气的体积为
A.504 mL B.336 mL C.224 mL D.168 mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
下列各组离子一定能够大量共存的是
A.使紫色石蕊变红的溶液:Fe2+、Mg2+、NO 、C1-
、C1-
B.含有较多A13+的溶液:SO42-、Na+、Mg2+、NO
C.含有较多Fe3+的溶液:Na+、SO42-、SCN-、CO32-
D.无色透明的酸性溶液:MnO4—、K+、C1-、HCO3—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:填空题
(10分)X、Y、Z、R、W为五种原子序数依次增大的短周期元素。
已知:①X元素的原子半径是所有原子中最小的;
②Y元素的原子最外层电子数是最内层电子数的2倍。
③Y与R可以形成YR与YR2两种化合物,其中一种是造成温室效应的物质之一。
④W与R能形成原子个数之比为2:1和1:1的离子化合物甲和乙。
根据要求回答问题:
(1)R在周期表中的位置是_______________;甲的电子式是___________。
(2)元素Y、R的最简单氢化物的稳定性由大到小顺序为 (填化学式)。
(3)X2R与乙反应的化学方程式是__________________。
(4)元素Y、R、W形成的化合物的水溶液常用作清洗厨房的油污,其原理是(用离子方程式表示) 。欲使0.1mol·L-1该溶液中浓度最大的阳离子与浓度最大的阴离子浓度之比=2,可以加入的物质是 (填一种)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第一次模拟考试化学试卷(解析版) 题型:填空题
(12分)化学链燃烧是将燃料与载氧体再被空气氧化再生,以实现较低温度下燃烧的过程。该过程具有无火焰、低污染、高效率的特点。
(1)用煤作燃料时,需要先用H2O或CO2将煤转化为燃料气。950℃时,焦炭被H2O氧化后产物的体积分数如图所示、其中H2含量较多的原因是 、(用化学方程式表示)
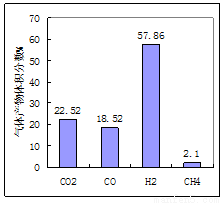
(2)燃料反应的气体产物主要是H2O和CO2通过 (填操作名称)分离出水,并回收CO2。
(3)CaSO4是一种载体,请写出CaSO4与H2反应的化学方程式 ;CO还原载体CaSO4的主要反应是①,副反应是②
①CaSO4( s)+4CO(g)=CaS(s)+4CO2(g) △H=-175.6 kJ.mol-1
②CaSO4(s)+CO(g)=CaO(s)+CO2(g)+SO2(g) △H=+218.4 kJ.mol-
右图是CO与CaSO4在900℃反应后,固体的物质的量分数与n(CaSO4)/n(CO)的关系图。

当n(CaSO4)/n(CO)>0.25时,产生对环境影响的气体是 ,你的理由 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
人体内所必需的下列元素中,因摄入量不足而导致骨质疏松的是
A.K B.Ca C.Na D.Fe
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com