
(14分)汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
①c1合理的数值为 。(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)= 。
③不能作为判断该反应达到平衡状态的标志是 。(填字母标号)
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:

实验 编号 | T/oC | NO初始浓 度/10-3mol·L-1 | CO初始浓 度/10-3mol·L-1 | 催化剂的比 表面积/m2·g-1 |
① | 350 | 1.20 | 5.80 | 124 |
② | 280 | 1.20 | 5.80 | 124 |
③ | 280 | 1.20 | 5.80 | 82 |
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为 。
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K= 。
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650oC下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为 。
(14分)
(1)+180.5 (2)①D ②3.75×10-4mol/(L·s) ③ab (3)③②①
(4)160 (5)CO-2e-+CO32-=2CO2
【解析】
试题分析:(1)根据盖斯定律可知:N2(g)+O2(g)=2NO(g)△H=-(-746.5 KJ/mol)-(-221.0 KJ/mol)+2(-393.5 KJ/mol)=+180.5 KJ/mol;(2)①由题中所给数据可知第1s~3s C(NO)减小3×10-4 mol/L,故1s~2s的变化量必介于1.5×10-4 mol/L~3×10-4 mol/L之间,故应选D项2.5;②前2s内的平均反应速率v(CO2)=v(NO)=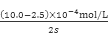 =3.75×10-4mol/L;③
=3.75×10-4mol/L;③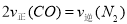 速率之比不等于化学计量数之比,故a项不能作为判断该反应达到平衡状态的标志;b.该反应前后均为气体,且为恒容体系,故容器中混合气体的密度始终保持不变,故b项不能作为判断该反应达到平衡状态的标志;该反应前后气体体积减小,压强降低,故容器中气体的压强不变,反应达到平衡状态,c项能作为判断该反应达到平衡状态的标志;平衡状态下各组分百分含量不变,故d项能作为判断该反应达到平衡状态的标志;本题选ab;(4)CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体由化合价改变关系可知,CO~2Ag,可得n(CO)=
速率之比不等于化学计量数之比,故a项不能作为判断该反应达到平衡状态的标志;b.该反应前后均为气体,且为恒容体系,故容器中混合气体的密度始终保持不变,故b项不能作为判断该反应达到平衡状态的标志;该反应前后气体体积减小,压强降低,故容器中气体的压强不变,反应达到平衡状态,c项能作为判断该反应达到平衡状态的标志;平衡状态下各组分百分含量不变,故d项能作为判断该反应达到平衡状态的标志;本题选ab;(4)CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体由化合价改变关系可知,CO~2Ag,可得n(CO)=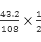 =0.2mol;可知平衡时各组分浓度分别为:C(NO)= C(CO)=0.2mol/L,C(N2)=(1-0.2)÷2=0.4mol/L, C(CO)=1-0.2=0.8mol/L,故平衡常数K=
=0.2mol;可知平衡时各组分浓度分别为:C(NO)= C(CO)=0.2mol/L,C(N2)=(1-0.2)÷2=0.4mol/L, C(CO)=1-0.2=0.8mol/L,故平衡常数K=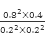 =160;(5)由题意可知负极为CO放电:CO-2e—+CO32—=2CO2。
=160;(5)由题意可知负极为CO放电:CO-2e—+CO32—=2CO2。
考点:化学反应原理。


科目:高中化学 来源:2014-2015吉林省高一上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是
A.单质硅是重要的半导体材料 B.二氧化硅是制造光导纤维的材料
C.硅酸钠可以做木材防火剂 D.自然界里存在大量的单质硅和二氧化硅
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol Na2O2与水完全反应时转移电子数为2NA
B.由2H和18O组成的水11 g,所含的中子数为5NA
C.14 g乙烯、丙烯的混合气体,含有C—H键数为2NA
D.50 mL 18 mol·L-1浓硫酸与足量铜反应,转移的电子数为1.8NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
下表为元素周期表前四周期的一部分,其中R为稀有气体元素,下列有关X、W、Y、R、Z(X、W、Y、R、Z分别代表元素符号)五种元素的叙述中,正确的是

A.常温常压下,五种元素的单质中有两种是气态
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y与W元素的最高价氧化物对应的水化物的酸性比较,前者弱于后者
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.用丁达尔现象可以区分乙醇溶液和淀粉溶液
B.16O转化为18O属于化学变化
C.实验室中,钠通常保存在盛有煤油的细口瓶中
D.定容时仰视容量瓶刻度线,所配制的NaOH溶液浓度将偏高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:填空题
(15分)目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:

(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:

①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 = 2NaI + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.质子数为92、中子数为143的铀(U)原子: 92235U
B.过氧化氢的电子式:
C.氯离子的结构示意图:
D.1,3—二甲基丁烷:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
某温度下,将2 mol A和1 mol B放入一密闭容器中,发生反应:A(g)+B(g) 2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
2C(s)+2D(g),5 min后反应达到平衡,测得生成C为0.8 mol,下列相关表述正确的是
A.该反应的化学平衡常数表达式是K=
B.若向平衡体系中加入少量生成物C,则正、逆反应速率均增大
C.增大该体系的压强,A的转化率增大
D.该条件下B的平衡转化率是40%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com